-
厌氧甲烷氧化过程根据电子受体不同通常可分为3类:一是硫酸盐还原型厌氧甲烷氧化(sulphate-dependent anaerobic methane oxidation,SAMO)[1];二是反硝化型厌氧甲烷氧化(denitrifying anaerobic methane oxidation,DAMO)[2-4];三是金属氧化物(铁、锰依赖型)[5-6]和重金属盐类(重铬酸盐、钒酸盐型)[7-8]厌氧甲烷氧化。反硝化型厌氧甲烷氧化(DAMO)工艺是近年来发现的一种新型脱氮工艺,其以CH4为电子供体,
${\rm{NO}}_3^ - $ 或${\rm{NO}}_2^ - $ 为电子受体实现反硝化脱氮[9-11]。RAGHOEBARSING等[12]从荷兰运河沉积物中富集培养出反硝化型厌氧甲烷氧化微生物群落,检测到甲烷、亚硝酸盐和硝酸盐的同时消耗以及氮气的排放。通过进一步研究证明,所消耗的亚硝酸盐和硝酸盐与所产生的氮气量相当,首次证实厌氧甲烷氧化与反硝化作用的存在。有研究[13-14]发现,DAMO富集体系中通常包含以${\rm{NO}}_2^ - $ 为氮源的NC10门细菌和以${\rm{NO}}_3^ - $ 为氮源的DAMO古菌存在。通过DAMO古菌和DAMO细菌的配合,可实现废水中氮素的去除。由于DAMO过程不产生N2O,可以直接利用甲烷,减少温室气体的排放,且避免了反硝化过程中外加碳源引起的二次污染,同时实现废水中${\rm{NO}}_3^ - $ 和${\rm{NO}}_2^ - $ 的有效脱除等优点,近几年引起了研究者的广泛关注[15]。但DAMO微生物存在代谢活性低、倍增时间长、富集培养困难、易受环境影响等问题[16-19]。由于DAMO细菌缺少普通好氧甲烷氧化菌具有的细胞内膜,pMMO酶是好氧甲烷氧化代谢的关键酶,多存在于细胞内膜上,而DAMO细菌仅有胞质膜可供pMMO酶结合,大大限制了DAMO细菌细胞内部的甲烷氧化代谢过程,使得DAMO细菌代谢活性降低,无法更好的与DAMO古菌配合完成整个反硝化过程[20-21]。此外,由于DAMO微生物对环境要求严格,2%的氧气就会抑制DAMO过程,且甲烷作为DAMO的唯一电子供体,其在水中溶解度低,限制了甲烷传质效率,影响了DAMO的富集。LI等[22]以硝酸盐为底物进行为期600 d的DAMO培养时,测序结果显示仍没有DAMO古菌的存在。赵荣等[23]对亚硝酸盐依赖型DAMO微生物活性影响因素进行了研究,确定了最佳温度为35 ℃,最佳pH为7.5,以及最适亚硝酸盐初始浓度为2.4~3.42 mmol·L−1,但目前几乎没有针对硝酸盐依赖型DAMO微生物活性影响因素方面的研究。基于此,本研究采用不同氮源反应器进行了硝酸盐依赖型DAMO功能微生物的富集,得到DAMO功能菌;采用厌氧小瓶序批式实验,探索了其最佳运行环境,优化工艺参数;通过高通量测序手段分析了微生物群落结构的变化,探究了其反应机理,实现了DAMO功能微生物的富集与影响因素的优化。
全文HTML
-
由于DAMO过程最有可能发生在甲烷和氮源丰富的厌氧或缺氧环境中[24],为提高富集成功率,本研究接种污泥来自于北京市海棠花溪河道底泥,北京市小红门再生水厂回流污泥,延庆水稻田土和延庆池塘底泥,培养液成分与ETTWIG培养时一致[25]。
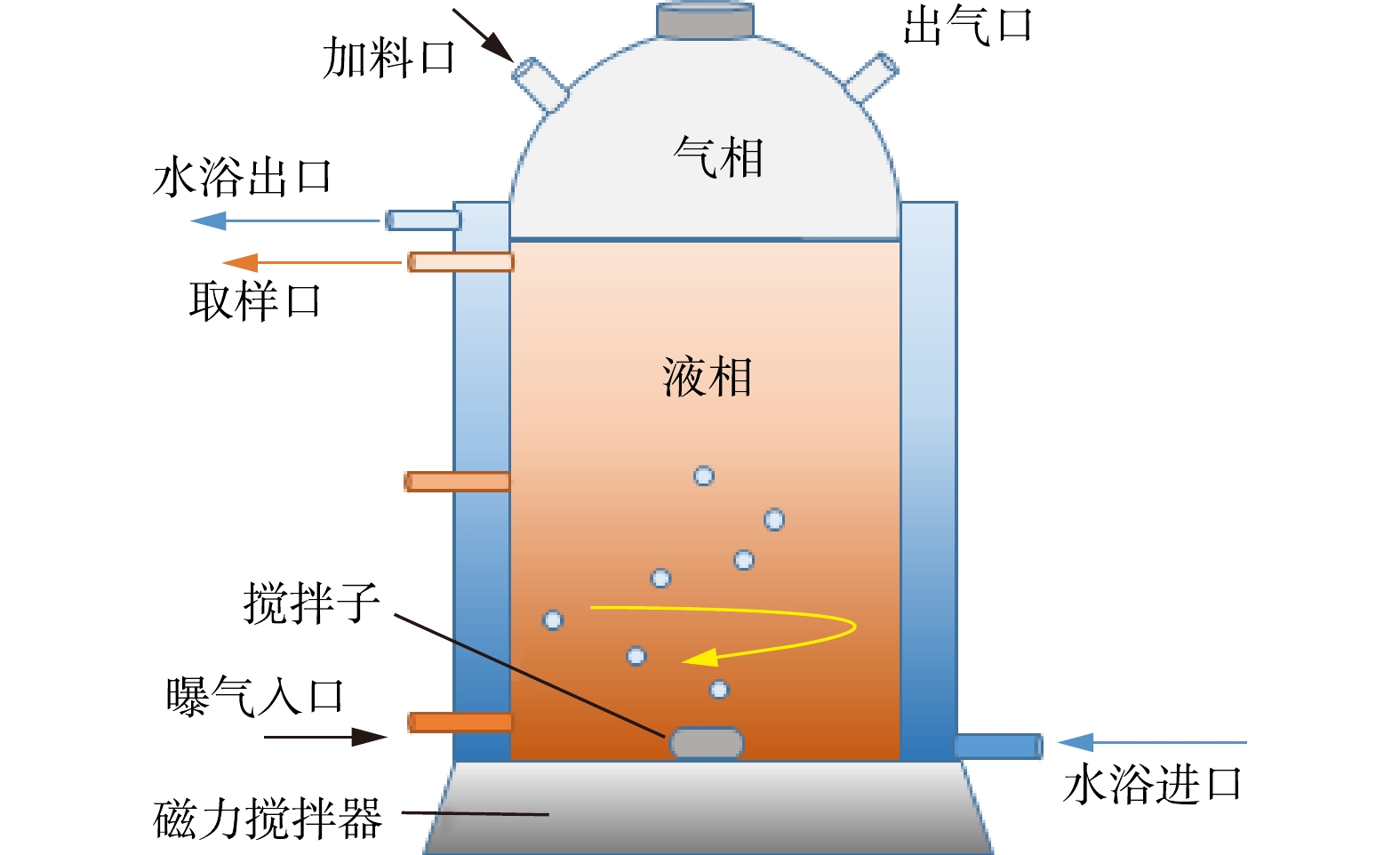
实验采用SBR进行富集,装置如图1所示。反应器为玻璃材质,采用双层结构,夹层为水浴间,起恒温保温作用。反应器内径为15 cm、高为30 cm,内部有效体积为4.0 L,分为液相区(3.0 L)和顶部气相区(1.0 L)。进样口和取样口处设置橡胶塞,防止环境中氧气进入反应器。富集期间保持严格厌氧,溶解氧浓度低于检出限。通过底部磁力搅拌器混合培养液,通过下部进气口通入甲烷,采用循环水浴保持温度恒定在35 ℃,采用HCl或KOH溶液调节反应器pH保持在7.0~7.5。
由于DAMO微生物倍增时间长且富集时间久,为防止大量微生物流失,反应器氮源通过高浓度氮浓缩液的方式在加料口补充,以减少进出水导致的生物量流失。SBR运行周期包括进水-反应-沉淀-排水,一个运行周期为30 d,每个月最后一天停止搅拌使反应器沉淀4 h,排去反应器内1/2水,补充培养液至3 L,继续正常运行。每5 d对反应器中甲烷更新一次,保证甲烷充足。每周取水样2~3次,持续监测反应器中
${\rm{NH}}_4^ + $ 、${\rm{NO}}_2^ - $ 和${\rm{NO}}_3^ - $ 浓度的变化。富集培养分为2个阶段,在阶段1中首先采用硝态氮为氮源进行DAMO古菌的富集,在反应器运行稳定后,再进行不同氮源的反应器富集效果对比(阶段2)。阶段1中的具体方法为:采用SBR对原始泥样进行为期80 d的初期培养,加入新鲜培养液,氮源仅为
${\rm{NO}}_3^ - $ ,投加${\rm{NO}}_3^ - $ 浓缩液使反应器中${\rm{NO}}_3^ - $ 浓度在50~110 mg·L−1,持续监测${\rm{NO}}_3^ - $ 浓度,计算转化速率,当${\rm{NO}}_3^ - $ 消耗殆尽时,再补充${\rm{NO}}_3^ - $ 浓缩液,保证底物不受限。阶段2的具体方法为:平行启动2组SBR,在SBR-1和SBR-2反应器中分别接种500 mL的初期富集培养物,加入培养液到3 L混合均匀。SBR-1加入氮源仅为${\rm{NO}}_3^ - $ (30~50 mg·L−1),SBR-2加入氮源为${\rm{NO}}_3^ - $ (40~70 mg·L−1)、${\rm{NH}}_4^ + $ (30~70 mg·L−1)、${\rm{NO}}_2^ - $ (10 mg·L−1),持续监测${\rm{NH}}_4^ + $ 、${\rm{NO}}_2^ - $ 、${\rm{NO}}_3^ - $ 浓度,当底物消耗殆尽时,再补充氮浓缩液,保证底物不受限。研究不同氮源反应器DAMO功能菌富集效果的影响。 -
采用有效体积150 mL的透明血清瓶进行实验,加入20 mL活性较高的SBR-2中富集220 d的培养物与100 mL新鲜培养液,用高纯氮气(99.999%)向液相中曝气10 min,橡胶塞密封,维持瓶中厌氧环境。采用排液法向瓶内充99.99%的甲烷40 mL,为避免多氮源体系中反应复杂对DAMO活性影响研究产生干扰,血清瓶中只加硝态氮,硝态氮初始浓度50 mg·L−1,进行避光、150 r·min−1恒温振荡培养,待体系稳定后进行影响因素实验。
本研究设置3个影响因素实验(表1),包括pH、温度与甲烷分压。每组实验设置3个平行,甲烷分压通过调节顶空甲烷与氮气比例设置,pH通过加入HCl和KOH溶液调节。
-
硝态氮、亚硝态氮、氨氮采用分光光度法进行测定(DR6 000,HACH),MLVSS采用重量法进行计算。甲烷总量为气相甲烷与液相甲烷之和,气相甲烷采用Techcomp公司GC7 900气相色谱仪和FID检测器(美国安捷伦科技公司)进行检测,液相中甲烷浓度按照式(1)进行计算。
式中:
$ {X}_{\mathrm{s}} $ 为溶液中甲烷浓度;$ {X}_{\mathrm{a}} $ 为摇晃后顶空甲烷浓度;$ {V}_{\mathrm{a}} $ 为顶空体积,mL;${b} $ 为甲烷液气分配系数,25 ℃时取0.03;$ {V}_{\mathrm{s}} $ 为溶液体积,mL。 -
在SBR-1和SBR-2反应器运行结束后,取2个反应器中适量样品进行DNA提取。DNA提取及纯化过程参照北京艾德莱生物科技有限公司DNA快速提取试剂盒说明书进行,将提取并纯化的DNA样品委托北京美吉生物医药科技有限公司进行第二代高通量测序。采用表2所示引物进行PCR扩增。高通量测序在Illumina Hiseq 2000平台(Illumia, San Diego, USA)上进行。相似度97%以上的序列合并为一个操作分类单位(OTU)。根据OTU聚类,进行各分类学水平上的群落结构与组成分析。
1.1. 富集装置与方法
1.2. DAMO影响因素实验方法
1.3. 分析测试方法
1.4. 微生物分析方法
-
图2(a)表示在阶段1(0~80 d)的SBR中
${\rm{NO}}_3^ - $ 、${\rm{NO}}_2^ - $ 、${\rm{NH}}_4^ + $ 浓度随时间的变化。由图2(a)可知,外加氮源仅为${\rm{NO}}_3^ - $ ,当${\rm{NO}}_3^ - $ 浓度低于5 mg·L−1时,补充${\rm{NO}}_3^ - $ 保证基质不受限,在整个培养初期,${\rm{NO}}_2^ - $ 浓度在0~5.06 mg·L−1,未发生${\rm{NO}}_2^ - $ 积累,氨氮浓度持续缓慢升高,通过换水的方式控制,分析氨氮的产生主要由于大量微生物细胞死亡裂解所致。根据图2(b)对培养初期SBR中硝态氮降解速率进行了分析,可以看出,硝态氮降解速率可明显分为3个阶段。0~17 d时反应器
${\rm{NO}}_3^ - $ 降解速率较低,且呈逐渐下降趋势,从45 mg·(L·d)−1降至11 mg·(L·d)−1,此时初始接种物中残留有机碳为反硝化过程提供碳源。17~30 d时${\rm{NO}}_3^ - $ 降解速率呈现先升高后降低的趋势,由11 mg·(L·d)−1逐步升高至79 mg·(L·d)−1再降低至20 mg·(L·d)−1。前期上升的原因为,反应器进入内源代谢阶段,微生物利用自身贮藏物质和酶等来取得营养物质,此时大量细胞裂解死亡产生的碳源为反硝化提供电子供体,硝氮降低速率逐渐上升;后期下降的原因为,反应器内残余的除甲烷外的碳源被不断消耗而得不到补充,内源反硝化活性不断降低,硝氮降低速率逐渐下降。31~80 d反应器${\rm{NO}}_3^ - $ 降低速率逐渐趋于稳定,基本保持在5 mg·(L·d)−1到30 mg·(L·d)−1,反应器进入漫长的停滞期。此外,在第40天和第80天分别测定CH4消耗速率与${\rm{NO}}_3^ - $ 消耗速率之比,用来表示DAMO对${\rm{NO}}_3^ - $ 转化的贡献占比。40 d时CH4/${\rm{NO}}_3^ - $ 消耗计量比为0.06,80 d时CH4/${\rm{NO}}_3^ - $ 消耗计量比为0.18,虽然仍未达到DAMO理论计量比0.625,但比值升高表明DAMO过程对${\rm{NO}}_3^ - $ 降解的贡献占比缓慢升高。为提高富集成功率,在初期培养后分别采用含有不同氮源的SBR反应器对DAMO微生物进行培养,SBR-1氮源为
${\rm{NO}}_3^ - $ ,SBR-2氮源为${\rm{NO}}_2^ - $ 、${\rm{NO}}_3^ - $ 、${\rm{NH}}_4^ + $ ,反应器运行方式同初期富集方式。图3(a)与图3(b)分别表示SBR-1和SBR-2反应器中${\rm{NO}}_2^ - $ 、${\rm{NO}}_3^ - $ 、${\rm{NH}}_4^ + $ 浓度随时间变化过程。由图3(a)可知,SBR-1中${\rm{NO}}_2^ - $ 浓度始终在6.3 mg·L−1以下,未发生${\rm{NO}}_2^ - $ 积累,氨氮浓度持续到第113天时开始下降,直到第140天时降为0 mg·L−1,此后再未出现氨氮的积累,这表明微生物死亡率下降,由细胞裂解产生的氨氮不再出现,反应器内源反硝化阶段结束。对SBR-1和SBR-2反应器中硝态氮转化速率进行分析,结果如图4(a)与图4(b)所示。富集结束时SBR-1硝氮降低速率为0.3 mg·(L·d)−1,SBR-2硝氮降低速率为2.8 mg·(L·d)−1。虽然反硝化速率有所波动,但从80~220 d的平均值也可以看出,SBR-1硝氮降低速率平均值为0.90 mg·(L·d)−1,SBR-2硝氮降低速率平均值为1.38 mg·(L·d)−1,所以多氮源相比于单一氮源的反应器更有助于DAMO古菌的富集。其主要原因可能是,在多氮源反应器中除了硝氮外,还添加了氨氮与亚硝氮,在厌氧环境下培养出部分anammox细菌,anammox细菌对
${\rm{NO}}_2^ - $ 的亲和常数要低于DAMO细菌,对${\rm{NO}}_2^ - $ 的竞争能力更强,限制了DAMO细菌的大量繁殖,从而促进DAMO古菌对甲烷的利用,有利于DAMO古菌的富集。所以Anammox-DAMO系统联合作用有助于DAMO古菌的富集培养,从而提高硝氮转化速率。这与FU等[26]的研究结果一致,他们发现,在添加不同氮源时DAMO功能菌的富集培养过程中,当采用${\rm{NO}}_2^ - $ 、${\rm{NO}}_3^ - $ 、${\rm{NH}}_4^ + $ 为氮源时硝氮转化速率最快。前期有研究[12, 27-28]表明,DAMO微生物富集时间在300~600 d时反硝化速率为0.18~2 mmol·(L·d)−1,本实验在220 d时就达到了2.8 mg·(L·d)−1,有效缩短了培养时间。由表3可知,SBR-1和SBR-2反应器在富集末期存在明显的CH4消耗,这说明在2个反应器中均存在DAMO过程。此外2个反应器中实际CH4/
${\rm{NO}}_3^ - $ 消耗计量比均小于理论DAMO计量比值,引起这一偏差的原因,可能是由于系统中存在有机残留物(如微生物代谢产物等)时的异养反硝化作用所导致的。 -
1)不同氮源反应器微生物多样性差异分析。富集结束后对SBR-1和SBR-2中的微生物进行了群落结构分析(表4)。shannon、simpson指数反映群里多样性,simpson指数越大,说明群落多样性越低,shannon值越大,说明群落多样性越高,chao、ace指数反映群落丰富度,值越大,群落丰富度越高[29]。综合SBR-1和SBR-2反应器中古菌多样性指数可以看出,SBR-2比SBR-1中古菌的多样性更高,丰富度更高。而从细菌群落多样性指数可以看出,SBR-1比SBR-2多样性更高,但SBR-2丰富度更高。所以多氮源富集培养DAMO比仅用硝氮培养DAMO的反应器群落结构更加丰富,微生物多样性更高。
2)不同氮源反应器微生物群落结构分析。对2个反应器中细菌群落与古菌群落结构差异进行了详细解析。对细菌门水平分析发现,SBR-1中丰度前5的门及其占比分别为Proteobacteria (23.12%)>Patescibacteria (17.83%)>Chloroflexi (14.55%)>Actinobacteria (11.88%)>Acidobacteria (9.72%)。SBR-2中丰度前5的门及其占比分别为Patescibacteria (27.29%)>Chloroflexi (16.06%)>Proteobacteria (15.30%)>Actinobacteria (11.11%)>Bacteroidetes (6.91%)。需特别注意的是,2个反应器中均含有少量的NC10门细菌,其中SBR-1中NC10占0.16%,SBR-2中NC10占0.1%,NC10门细菌是典型的亚硝酸盐依赖型甲烷厌氧氧化反硝化细菌[30],其主要利用
${\rm{NO}}_2^ - $ 为电子受体,甲烷为电子供体,在厌氧环境下进行反硝化型甲烷厌氧氧化,从而达到废水中溶解甲烷与${\rm{NO}}_2^ - $ 的同步去除。根据图5,对不同氮源SBR中细菌在目和属水平上进行分析,发现Candidatus_Nomurabacteria目在SBR-1和SBR-2中占比分别为6.54%和3.38%,其通常大量参与氮、硫和铁循环的自养类群,与溶解氧负相关。此外,在SBR-1和SBR-2中均发现厌氧氨氧化细菌,SBR-1中厌氧氨氧化菌占0.30%,SBR-2中厌氧氨氧化菌占0.56%。具体共有3种厌氧氨氧化菌属:Candidatus_Brocadia在SBR-1中占0.29%,在SBR-2中占0.24%;Candidatus_Kuenenia在SBR-1中未发现,在SBR-2中占0.29%;Candidatus_Anammoximicrobium在SBR-1中占0.01%,在SBR-2中0.03%。可见,在SBR-2中厌氧氨氧化细菌的相对丰度大于SBR-1中。虽然SBR-1的微生物培养时并未外加氨氮与亚硝氮,但大量细胞裂解死亡产生的氨氮为厌氧氨氧化菌的存在提供条件,且亚硝氮的存在很可能是由于DAMO古菌将
${\rm{NO}}_3^ - $ 还原为${\rm{NO}}_2^ - $ ,所以从侧面证实DAMO古菌存在的可能。对含有不同氮源SBR中古菌门水平群落结构分析可知,SBR-1和SBR-2中前5类主要的门种类一致。其中,广古菌门Euyarchaeota在SBR-1和SBR-2中丰度均为最高,占比分别是82%和80%,它通常包含了古菌中的大多数种类,包括产甲烷菌、在极高盐浓度下生活的盐杆菌、一些超嗜热的好氧和厌氧菌等。其他古菌占比依次为奇古菌门Thaumarchaeota (SBR-1中占8.0%,SBR-2中占6.2%)、泉古菌门Crenarchaeota (SBR-1中占5.7%,SBR-2中占3.7%)和纳古菌门Nanoarchaeaeota (SBR-1中占0%,SBR-2中占6.7%)。
由图6可知,对含不同氮源SBR中的古菌属水平进行分析发现,SBR-1中丰度前5的属及其占比分别为:甲烷杆菌属Methanobacterium (49.76%)>甲烷短杆菌Methanobrevibacter (10.04%)>甲烷八叠球菌Methanosarcina (9.76%)>Methanomassiliicoccus (2.42%)>Rice_Cluster_I (2.26%)。SBR-2中丰度前5的属及其占比分别为:甲烷杆菌属Methanobacterium (40.99%)>甲烷八叠球菌Methanosarcina (11.93%)>甲烷短杆菌Methanobrevibacter (10.85%)>Methanomassiliicoccus (2.70%)>甲烷鬃毛菌Methanosaeta (2.20%),可见,2个反应器中主要微生物均为产甲烷古菌,同时,均发现能够进行硝酸盐依赖型厌氧甲烷氧化反硝化(DAMO)的古菌Candidatus_Methanoperedens,分别在SBR-1中占0.02%,SBR-2中占0.03%。可见,DAMO古菌相对丰度在多氮源的SBR-2反应器中占比略高于单一氮源的SBR-1反应器。结合之前微生物细菌的比较分析,可发现,厌氧氨氧化细菌较多时DAMO古菌丰度更高,分析原因主要由于厌氧氨氧化细菌可限制DAMO细菌的增殖,减少其对甲烷的竞争,从而促进DAMO古菌对甲烷的利用,有利于DAMO古菌的富集,所以多氮源反应器中厌氧氨氧化细菌的增殖有助有DAMO古菌的富集。
-
1) pH对DAMO活性的影响。不同pH条件下的DAMO过程中的反硝化速率如图7所示。当pH为5.0、6.0、7.0、8.0时,对应的7 d内平均反硝化速率分别为0.222、0.296、0.292、0.178 mg·(L·d)−1。说明当pH为6.0时,反硝化速率最大,而pH为7.0时,反硝化速率略低于pH为6.0时。这也说明,当pH在6~7时DAMO活性最强,pH过高或过低均会抑制DAMO活性。目前已报道的DAMO微生物富集培养适合的pH多在6~8[31],ZHU等[32]的研究认为,当pH为7.4时DAMO反应活性最强,而HE等[33]研究表明,最适pH为7.6,在低于7.6时DAMO活性就会受到抑制。
2)温度对DAMO活性的影响。理论上,由于温度越低,甲烷在水中的溶解度越高,反应器中可利用的甲烷越多,反应性运行效能越好,但过低的温度会抑制反应器中微生物的活性,所以研究温度对DAMO反应的影响至关重要。图8显示了不同温度梯度下DAMO过程反硝化速率变化,可见,在当温度为25、30、35、40 ℃时,对应的7 d内平均反硝化速率分别为0.085、0.151、0.292和0.147 mg·(L·d)−1。所以,温度为35 ℃时,反硝化速率最大,DAMO活性最强。何崭飞[34]经过短期与长期不同温度的DAMO微生物培养也表明最适温度为35 ℃。而最新研究[35]表明,当长期运行时,MBfR温度从逐步从25 ℃降低到10 ℃仍能获得较好的DAMO活性,氮去除速率为0.13 kg·(m3·d)−1,所以,长期运行时温度对反应器的影响还需进一步探究。
3)甲烷分压对DAMO活性的影响。由于甲烷是DAMO过程的唯一碳源,而甲烷在水中的溶解度低限制了DAMO微生物的培养。在本研究中,当设置甲烷分压为25、50、75、100 kPa时,如图9所示,对应的7 d内相对反硝化速率分别为0.261、0.267、0.299、0.300 mg·(L·d)−1。可见,甲烷分压越高,反硝化速率越高;当甲烷分压在75~100 kPa时的反硝化速率高于甲烷分压为25~50 kPa的实验组。上述结果说明,较高的甲烷分压对DAMO功能有利。但甲烷分压为75 kPa和100 kPa时的2个实验组之间差别不明显,说明当甲烷分压大于75 kPa时,不再是DAMO功能的限制因素。赵荣等[23]的研究表明,甲烷分压在49 kPa以上即可满足DAMO细菌的富集培养。何崭飞等[36]通过建立甲烷传质模型表明,当甲烷分压为25.33 kPa时,不再是DAMO活性限制因素,并且提高搅拌速度有助于提高甲烷传质。
2.1. DAMO功能微生物的富集
2.2. DAMO功能微生物群落结构分析
2.3. DAMO活性影响因素分析
-
1)单一氮源(
${\rm{NO}}_3^ - $ )的SBR-1反应器和多氮源(${\rm{NO}}_3^ - $ ,${\rm{NO}}_2^ - $ ,${\rm{NH}}_4^ + $ )的SBR-2反应器富集末期硝氮降低速率分别为0.3 mg·(L·d)−1和2.8 mg·(L·d)−1,这说明多氮源比单一氮源更适合富集DAMO微生物。2) SBR-2反应器中厌氧氨氧化细菌和DAMO古菌相对丰度(0.56%和0.03%)比SBR-1中更高(0.3%和0.02%)。厌氧氨氧化细菌的增殖有助有DAMO古菌的富集。
3)根据工艺参数优化结果确定,DAMO反应最适pH为6~7、最适温度为35 ℃;当甲烷分压大于75 kPa时,DAMO反应速率不再受甲烷分压的限制。










 下载:
下载:















