-
2017年,我国餐饮业收入3.9×1012元,而该行业排放挥发性有机污染物(Volatile organic pollutants,VOCs)总量更高达66 244.59 t·a−1[1]。餐饮业油烟污染在某些城市的投诉量已上升为环保投诉案件的50%[2]。餐饮油烟中含有大量VOCs,会导致光化学烟雾污染事件发生[3-4]。同时,流行病学研究也证实餐饮油烟具有致癌风险[5]。因此,近年来,国内外学者针对餐饮源油烟污染开展了大量研究。从地域角度,对北京[6-7]、上海[8-9]、深圳[10]、成都[11]、保定[12]及兰州[13]等不同发达程度地区的餐饮油烟排放污染进行了研究;从餐饮类型角度,对不同菜系和餐饮类型产生的油烟污染进行对比分析[14-16];针对油烟产生过程,通过控制加热温度、油品、食材等因素来研究油烟排放特征及其变化[17-20]。这些研究多为聚焦餐饮油烟的排放特征,如排放浓度及成分等,而对油烟的处理和降解研究还较少。
生物法降解餐饮油烟废气的运行费用低,二次污染小且处理效率较高。LIAO等[21]利用餐饮废油驯化污水厂活性污泥获得了优势菌种以降解餐饮油烟;刘超等[22]分别向生物洗涤装置中放置不同填料,以研究微生物对液相油烟的降解效果;贾力强等[23]向驯化后的活性污泥中投加2种优势菌以强化洗涤液降解油烟VOCs的效果。
本研究利用驯化活性污泥来洗涤净化餐饮油烟中的VOCs,分析驯化过程中活性污泥的性状变化及其对气相油烟VOCs的洗涤效率,探究液相油烟VOCs的组成与微生物群落结构的变化,以评估不同阶段活性污泥对气相油烟VOCs的洗涤效果,并进一步明确液相油烟VOCs的组成与微生物群落之间的联系,以期为生物洗涤处理餐饮油烟的技术应用提供参考。
-
1)实验材料。金龙鱼食用调和油;餐馆烟气净化设备内冷凝油、辣椒油;污水处理厂活性污泥。
2)主要仪器。红外测油仪(JC-OIL-6A型,青岛聚创环保设备有限公司);便携式溶解氧测定仪(JPB-607A 型,上海仪电科学仪器股份有限公司);超声波清洗器(F-100S型,深圳福洋科技集团有限公司);气相色谱-质谱联用仪(Clarus 600 GC-MS,美国PerkinElmer公司)。
-
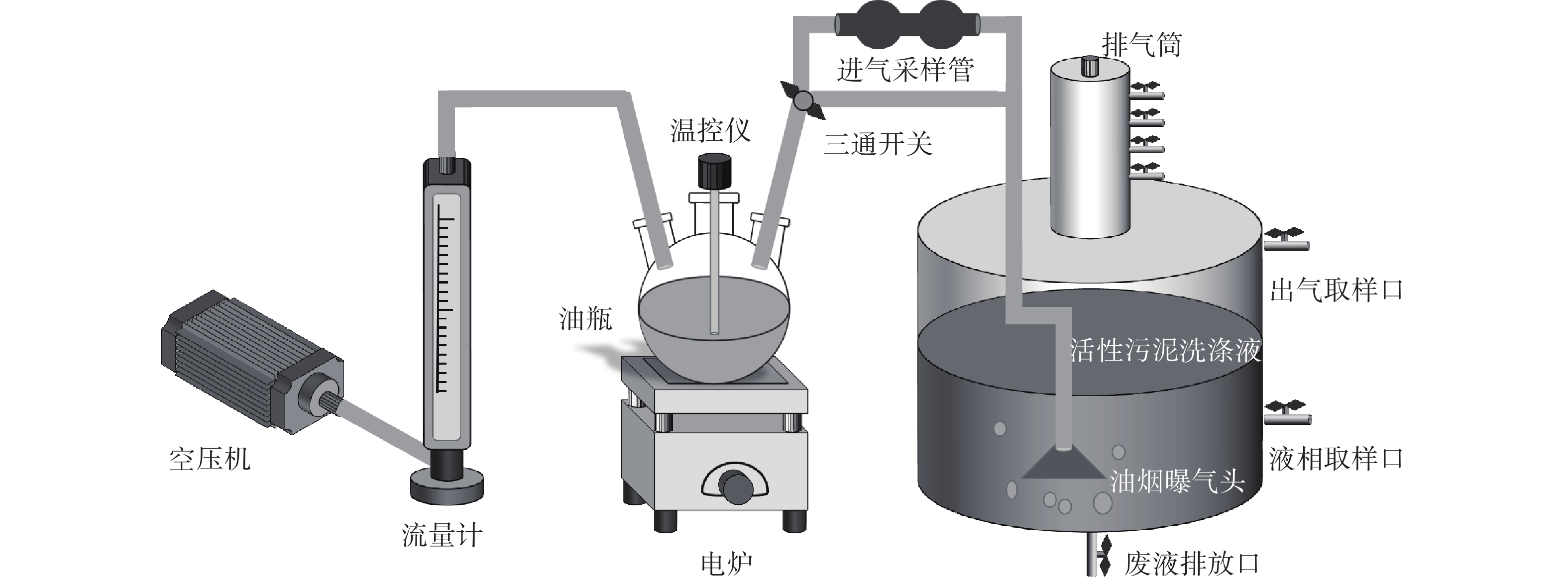
装置如图1所示。模拟油烟生成系统由空压机、转子流量计、三口油瓶和电炉组成。油烟净化部分则是由生物洗涤槽与排气筒串联而成。生物洗涤槽为直径400 mm、高400 mm的有机玻璃圆柱体。将300 mL冷凝废油、100 mL金龙鱼牌食用调和油及10 mL辣椒油混合加入体积为1 000 mL的三口烧瓶中[24-25],控制电炉使混合油升温至160 ℃,并用转子流量计使进气流量保持在0.5 m3·h−1,用以模拟餐饮油烟。
-
1)气相油烟样品的采集。在0.5 m3·h−1气流量下,采用装有5 g颗粒活性炭的吸附管吸附采样3 min;再将颗粒活性炭置于25 mL容量瓶中,加入15 mL四氯化碳;在超声波振荡萃取5 min后,把萃取液移入另一25 mL容量瓶中;向装有颗粒活性炭的容量瓶中加入10 mL四氯化碳;在超声振荡萃取3 min后,将萃取液移入相同容量瓶并定容;用生料带密封容量瓶口,放入冰箱(4 ℃)待测。
2)液相油烟样品的采集。取20 mL洗涤装置中的水样(用盐酸将其pH调至2以下)放入25 mL分液漏斗内,加入10 mL四氯化碳反复振荡3 min(摇晃过程中注意放气);静置分层后将下层液体置于50 mL锥形瓶内;继续向装有上层液体的分液漏斗中添加8 mL四氯化碳,在振荡3 min并静置分层后,将下层液体转移至另一相同锥形瓶内,再将其超声振荡至破乳;将锥形瓶中液体倒入洁净的分液漏斗,在振荡1 min并静置分层后,将下层液移入装有1 cm厚无水硫酸钠层的漏斗内,并过滤至25 mL容量瓶中;最后用生料带密封容量瓶口,放入4 ℃的冰箱待测。
3)油烟样品的检测。采用气相色谱-质谱对油烟样品成分进行分析。GC条件:Clarus 600 GC/MS气相色谱-质谱联用仪,色谱柱为Elite-5MS 石英毛细柱(30 m×0.25 mm,0.25 µm);载气为氦气,流速1 mL·min−1;碰撞气为氩气;进样口的温度为250 ℃,进样量1 µL,不分流;柱箱加热程序为维持初始温度(50 ℃)2 min后,以5 ℃·min−1速率加热至140 ℃;在140 ℃保持5 min后,以20 ℃·min−1速度升温至250 ℃,再保持12 min。MS条件:接口温度为250 ℃,EI源,电子能量为70 eV,扫描范围为50~550 m·z−1,溶剂延迟3 min。
-
由红外测油仪测得溶液中油的质量浓度为C0。油烟质量浓度及油烟去除率分别由式(1)和式(2)计算得到。
式中:C为油烟气体质量浓度,mg·m−3;C0为红外测油仪测得油的质量浓度,mg·L−1;V为容量瓶体积,mL;Q为气体流量,m3·h−1;t为采样时间,min;η为油烟去除率,%;C1为进口的油烟质量浓度,mg·m−3;C2为洗涤后出口的油烟质量浓度,mg·m−3。
由于受油温、食用油种类及烹调方法等因素影响,不同来源烹饪油烟中VOCs的组分差异较大,且种类繁杂,因此,多采用普库检索定性(匹配度>80%)及面积归一化法来定量分析油烟中的VOCs,得到烹饪油烟中有机物各组分的物质种类和含量[19,25]。由GC-MS测得污染物峰面积S,并通过式(3)计算系统对气相油烟VOCs的洗涤效率。
式中:ρ为某油烟污染物洗涤效率,%;S1为进口污染物峰面积;S2为洗涤后出口污染物峰面积。
液相油烟VOCs衰减降解第1天的归一化含量为第1天的相对质量分数。到第3天,其相对质量分数可由式(4)计算。同理,可计算往后某天的相对质量分数。
式中:ω3为某液相油烟VOCs第3天的相对质量分数,%;S1为该污染物衰减降解第1天的峰面积;S3为该污染物衰减降解第3天的峰面积;A1为该污染物第1天归一化含量,%。
-
1)活性污泥获取及预处理。从桂林市雁山镇污水处理厂取回30 L曝气池活性污泥进行预处理。将污泥放入洗涤装置(图1)中,启动曝气装置;调整进气量为0.5 m3·h−1进行充氧曝气,持续1 d,使得微生物通过内消耗先将污泥中自带的有机物去除掉;在室温((20±3)℃)条件下,向反应器内投加适量可溶性淀粉,并将COD控制在约1 000 mg·L−1;同时,投加NH4NO3、K2HPO4将氮、磷元素分别控制为约50和10 mg·L−1;调节pH使其维持在6.5~7.5,在此条件下培养3 d,使得微生物能快速适应环境并大量繁殖。
2)活性污泥驯化及油烟净化。实验共分为4个阶段:活性污泥驯化的3个阶段(25 d)及衰减实验阶段(5 d)。第1阶段为油烟接触阶段,采用隔天进气的方式进行驯化;通入油烟的时长分别为1、2、3、4和5 h;同时按COD控制值为900、800、700、600和 500 mg·L−1来添加淀粉,以保证碳氮磷比为100∶5∶1;用NaHCO3和盐酸将活性污泥pH调至7左右,并驯化10 d。第2阶段为油烟适应阶段,每天通入油烟5 h,按COD控制值为400、300、200、100 mg·L−1和0逐渐减少淀粉投加量,直至不添加,并驯化5 d。第3阶段为驯化完成阶段,在此阶段,微生物以油烟废气为唯一碳源,不断增大油烟的隔天通入时间,通气时长为6、7、8、9和 10 h,投加无机盐溶液来调控生物洗涤液中的氮磷等元素,持续驯化10 d。第4阶段为液相油烟净化衰减阶段,此阶段不通入油烟,用以演化活性污泥中微生物对餐饮油烟VOCs的降解过程;但此阶段仍需向活性污泥洗涤液中补加营养物质[26],即在每升活性污泥洗涤液中补加淀粉溶液(质量浓度为2.27 g·L−1)80 mL、NH4NO3溶液(质量浓度为2 g·L−1)24 mL、KH2PO4溶液(质量浓度为2 g·L−1)4 mL、微量元素溶液(质量浓度分别为0.03、0.1和0.043 g·L−1的CuSO4·5H2O、ZnSO4·7H2O和MnSO4·H2O)8 mL,并曝气培养5 d,将DO控制为7.1 mg·L−1。
-
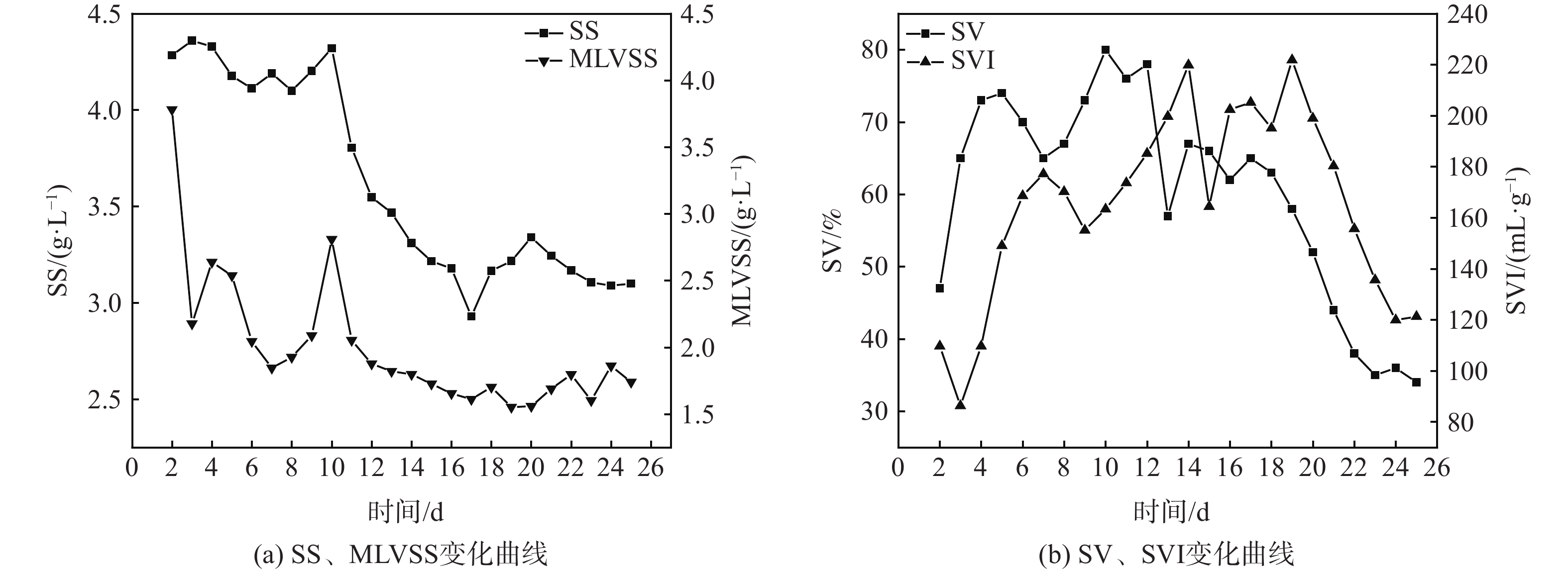
图2反映了驯化期间活性污泥各性能指标的变化。4项指标最后均趋于平稳:MLSS稳定在3.10 g·L−1;MLVSS稳定在1.60~1.90 g·L−1;污泥的沉降性能良好,SV、SVI恢复到正常值水平,分别稳定在35 %和120 mL·g−1。以上数据表明活性污泥已驯化成熟。
图3反映了驯化前后活性污泥的状态。驯化前,活性污泥呈现不规则片状结构,还可观察到微生物的存在;驯化后,活性污泥呈蜂窝状,微孔均匀分布且结构发达。这说明驯化后的活性污泥形状发生了明显变化。驯化前活性污泥呈离散型,而驯化后活性污泥为凝聚型,对油烟VOCs的捕获能力更强。
-
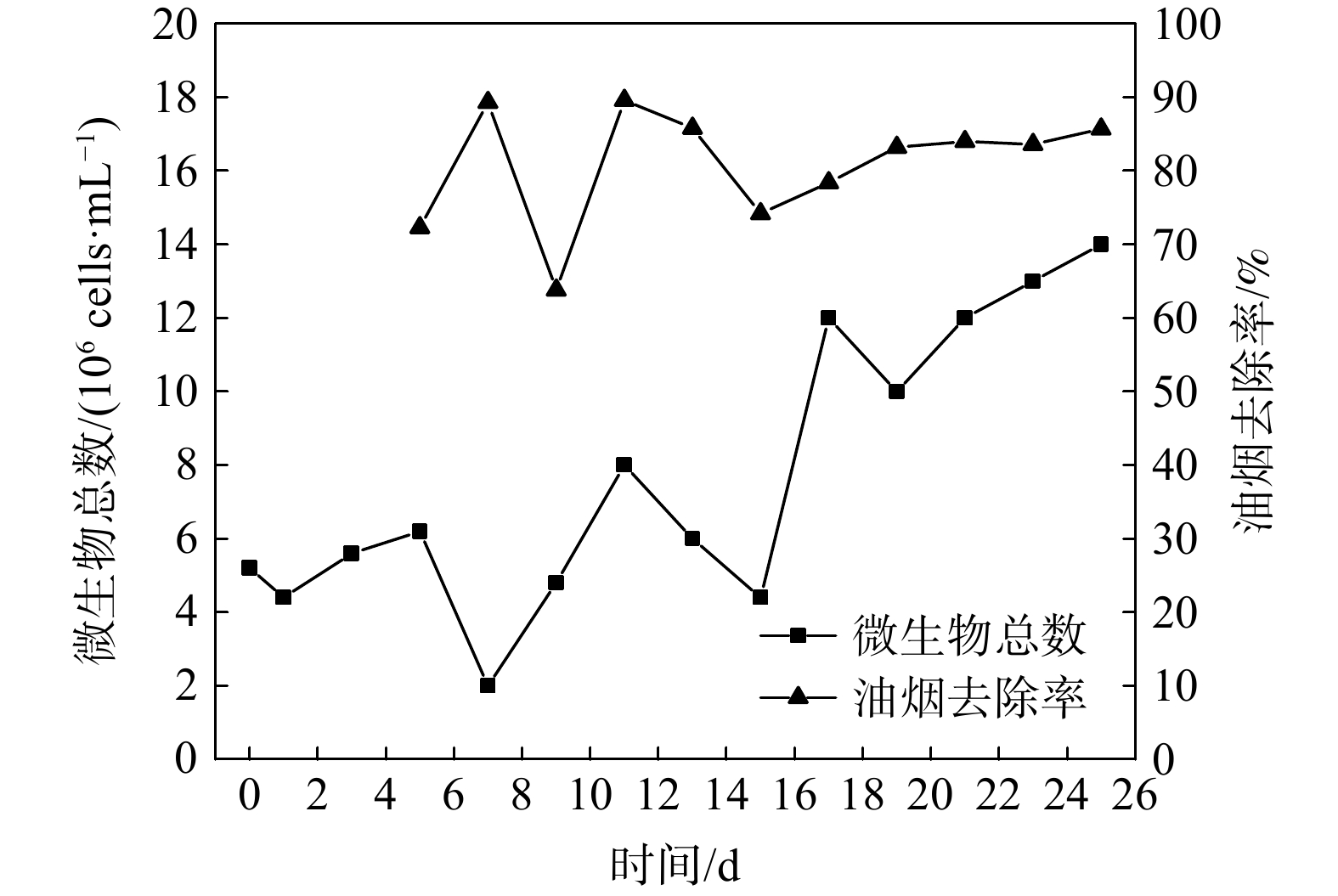
驯化过程中每隔1 d采集1次活性污泥样品。采用显微镜直接计数法[25]在光学显微镜下直接观察计数,并根据取样体积、稀释倍数等计算菌液浓度。从驯化第5天起,每隔1 d用红外测油仪测定进出口油烟的质量浓度。驯化阶段中活性污泥生物量的变化及其对油烟的净化效果如图4所示。在污泥驯化第1阶段前期,随着淀粉投加量减少、油烟通入时间延长,非噬油微生物会大量死亡,其生物量在第7天时降到最低点,而噬油微生物则在适应环境后开始增殖。进入驯化的第2阶段,随着油烟继续通入、淀粉投加量逐渐降为0,噬油微生物的生物量虽有反复,但总体呈快速增长趋势。在驯化的第3阶段,以油烟VOCs为唯一碳源的优势使得这些微生物进入生长稳定期,其生物量整体呈缓慢增长并逐渐稳定的趋势。在活性污泥驯化的前、中期,气相油烟的洗涤效率较高,但波动较大;而在驯化的后期,噬油微生物的增殖趋于稳定,油烟洗涤效率亦稳定在85%。
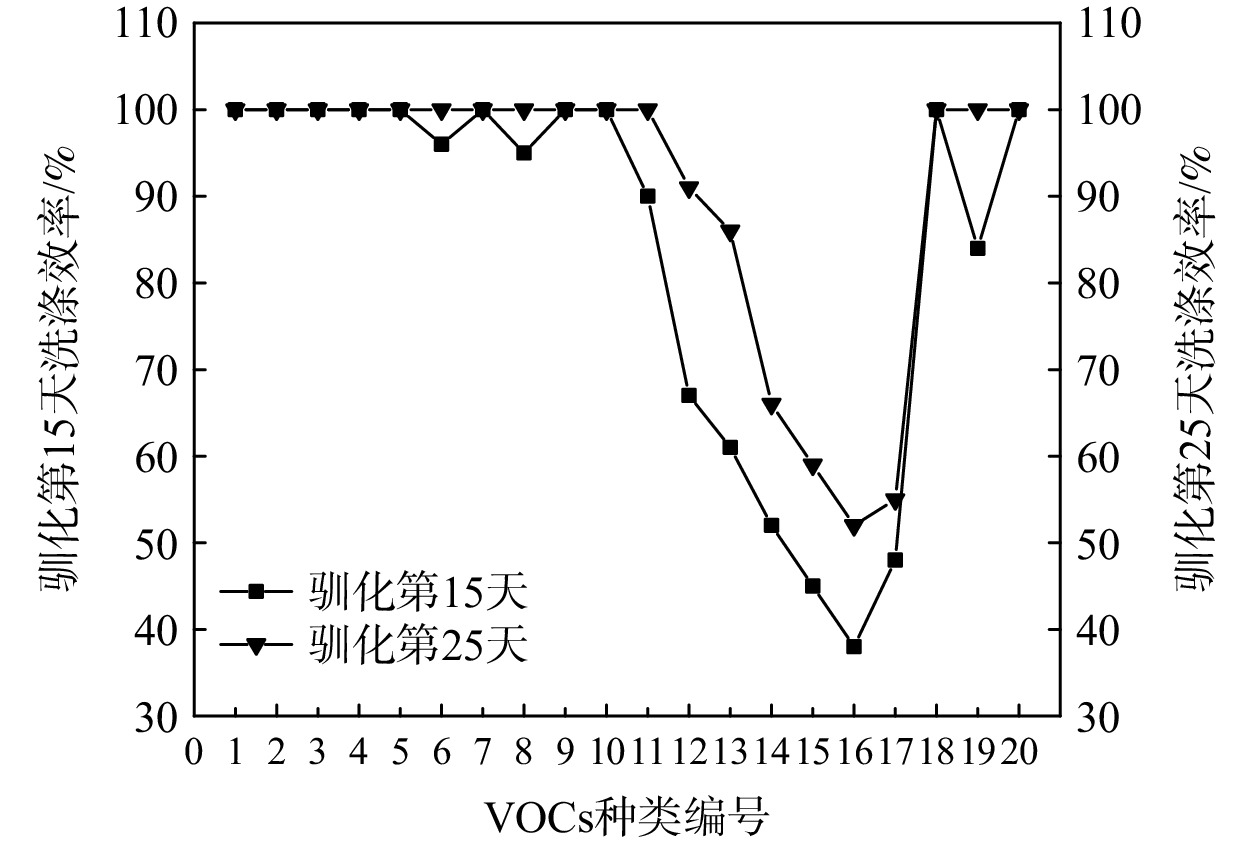
在活性污泥驯化过程的第2和第3阶段完成后,向系统中通入油烟,并采集洗涤装置进、出气口的油烟样品。利用GC-MS通过谱库检索鉴定出样品中的20种化合物,然后对系统的洗涤效果进行分析,结果如图5所示。
在驯化的第15天,活性污泥对餐饮油烟中烯醛类、醇类、烷烃类、酯类、柠檬烯、三氯甲基磺酰氯的洗涤效率均在95 %以上,但对部分直链醛类的洗涤效率较低,如己醛、庚醛、辛醛、壬醛、癸醛、2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)。在驯化的第25 天,活性污泥对己醛和庚醛的洗涤效率由67%和61%提升至91%和86%,而对一些难去除的物质,如辛醛、壬醛、癸醛、2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)的洗涤效率也分别由52%、45%、38%、48%提升至66%、59%、52%、55%。
-
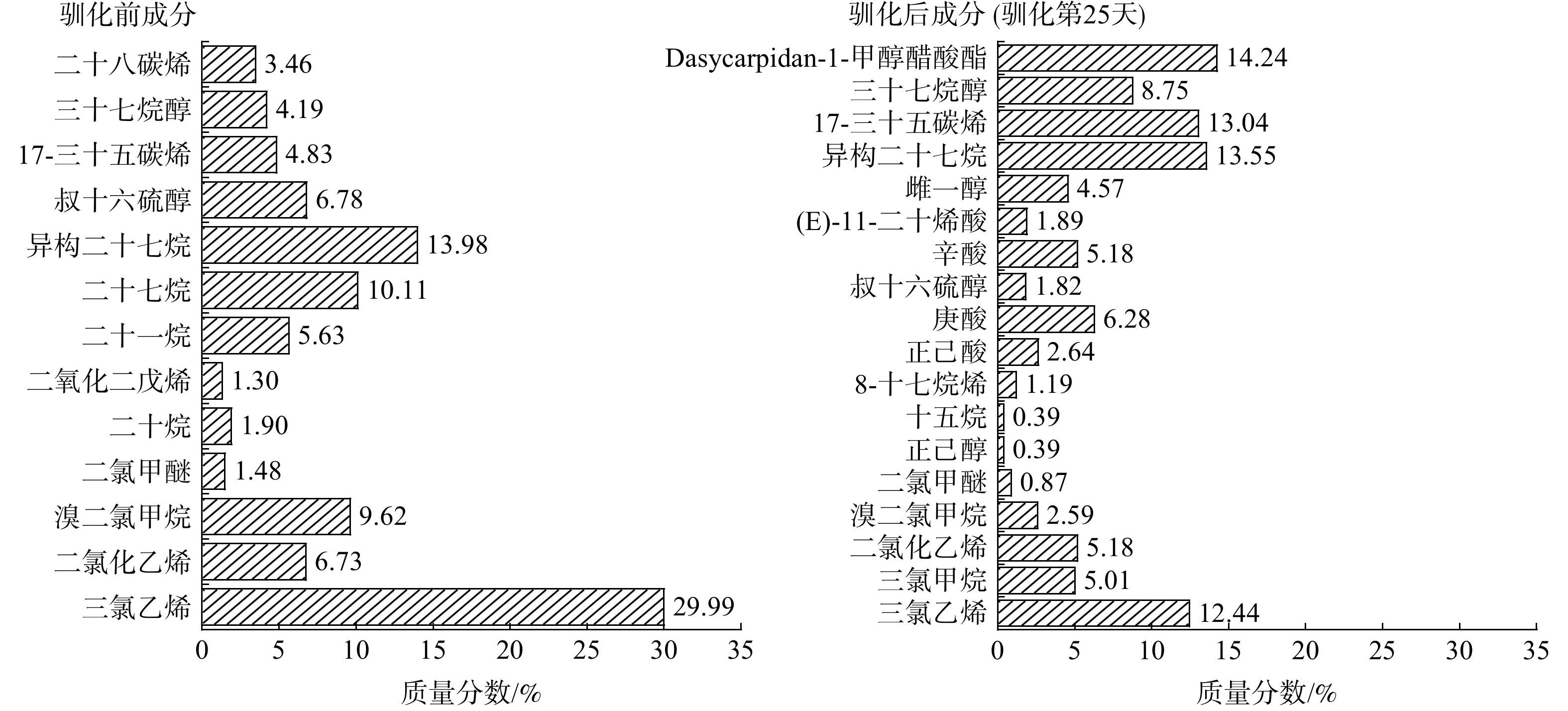
取驯化前、驯化后(即驯化第25天)的活性污泥洗涤液样品,利用GC-MS进行成分分析并通过谱库检索,分别测定驯化前后活性污泥洗涤液样品中的有机物种类和含量,结果如图6所示。驯化前,样品中有13种有机物,相对含量较高的组分有三氯乙烯(29.99%)、异构二十七烷(13.98%)、二十七烷(10.11%)、溴二氯甲烷(9.62%),即以氯代物和长链烷烃为主要成分。而驯化后样品中有18种有机物,出气口油烟样品中主要成分为Dasycarpidan-1-甲醇醋酸酯(14.24 %)、异构二十七烷(13.55%)、17-三十五碳烯(13.04%)、三氯乙烯(12.44%)、三十七烷醇(8.75%)。因此,驯化过程中污泥使得模拟餐饮油烟组分发生了很大变化,氯代物、长链烷烃及酯类成为驯化后油烟样品中新的主要成分。
-
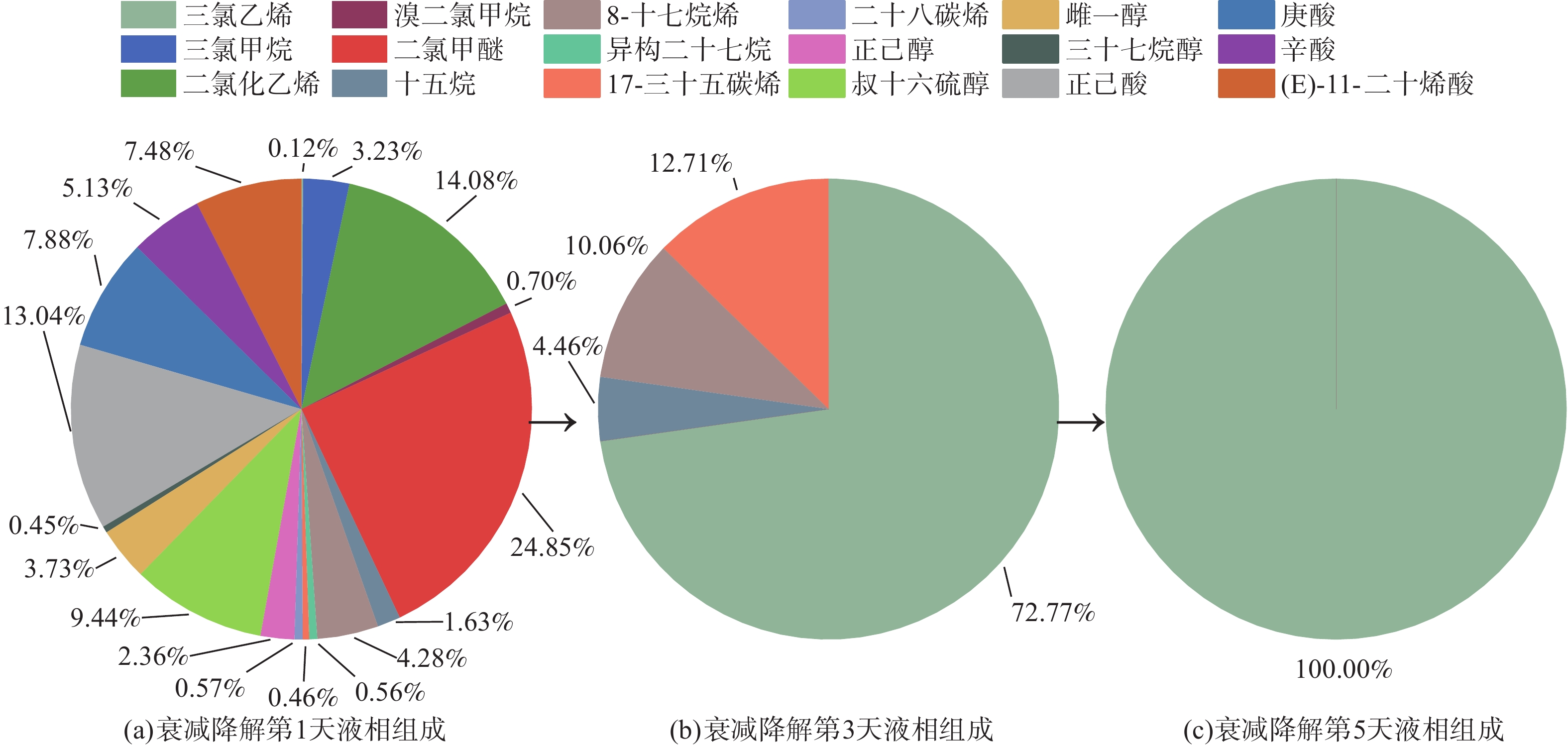
在活性污泥驯化完成后,向洗涤液中通入油烟至饱和,此时装置进出口油烟的组成和含量几乎一致,便停止通入油烟,进入液相油烟VOCs的生物衰减实验阶段。在此阶段,活性污泥中的微生物会利用系统中的油烟VOCs进行代谢活动。分别在衰减实验的第1天、第3天、第5天,取得液相样品。经过液液萃取再利用GC-MS对液相样品中的油相有机物进行分析,结果如图7所示。
在衰减实验第1天的液相样品中共检测出18种物质,包括卤代物、烃类、醇类和羧酸类4类。其中,卤代物所占质量分数最大(42.98 %),其次为羧酸类(33.53%)、醇类(15.98%),烃类最小(7.5 %);主要组成物质有二氯甲醚(24.85 %)、二氯化乙烯(14.08 %)、正己酸(13.04 %)、叔十六硫醇(9.44 %)。在衰减实验第3天的液相样品中仅检测到4种物质:三氯乙烯(72.77 %)、17-三十五碳烯(12.71 %)、8-十七烷烯(10.06 %)、十五烷(4.46 %)。在衰减实验第5天的液相样品中仅检测出三氯乙烯1种物质,其他物质几乎被完全降解,含量降至检出限以下。
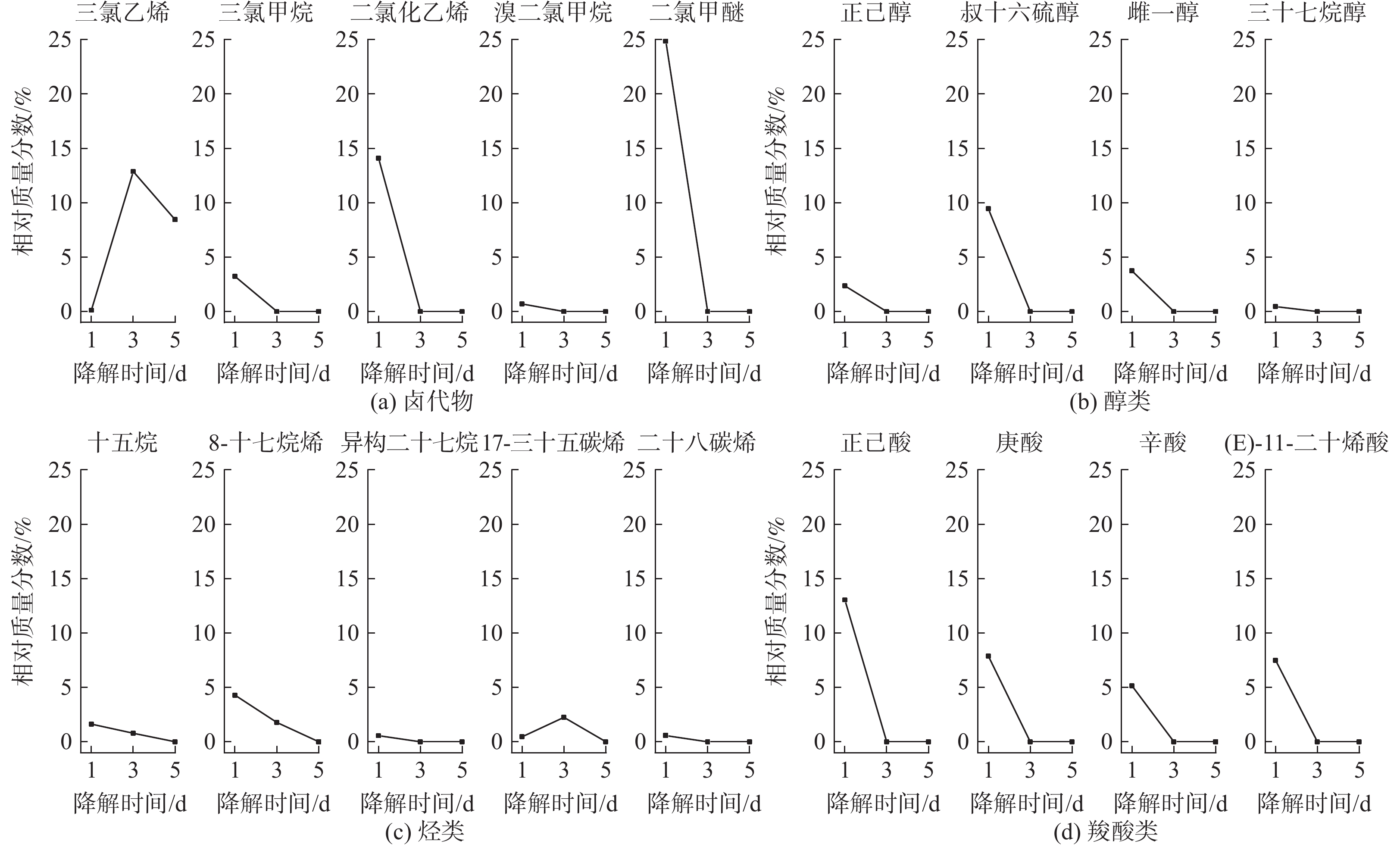
在5 d的衰减实验中,大部分有机物的含量在前3 d即降至检出限以下(图8)。这说明液相中大部分有机物可在较短时间内被微生物完全降解。仅三氯乙烯和17-三十五碳烯的相对质量分数在前3 d出现增大;在第4~5天,17-三十五碳烯的含量降至检出限以下,而三氯乙烯仍保持较高水平。这说明三氯乙烯和17-三十五碳烯属于餐饮油烟中较难生物降解的有机物。
-
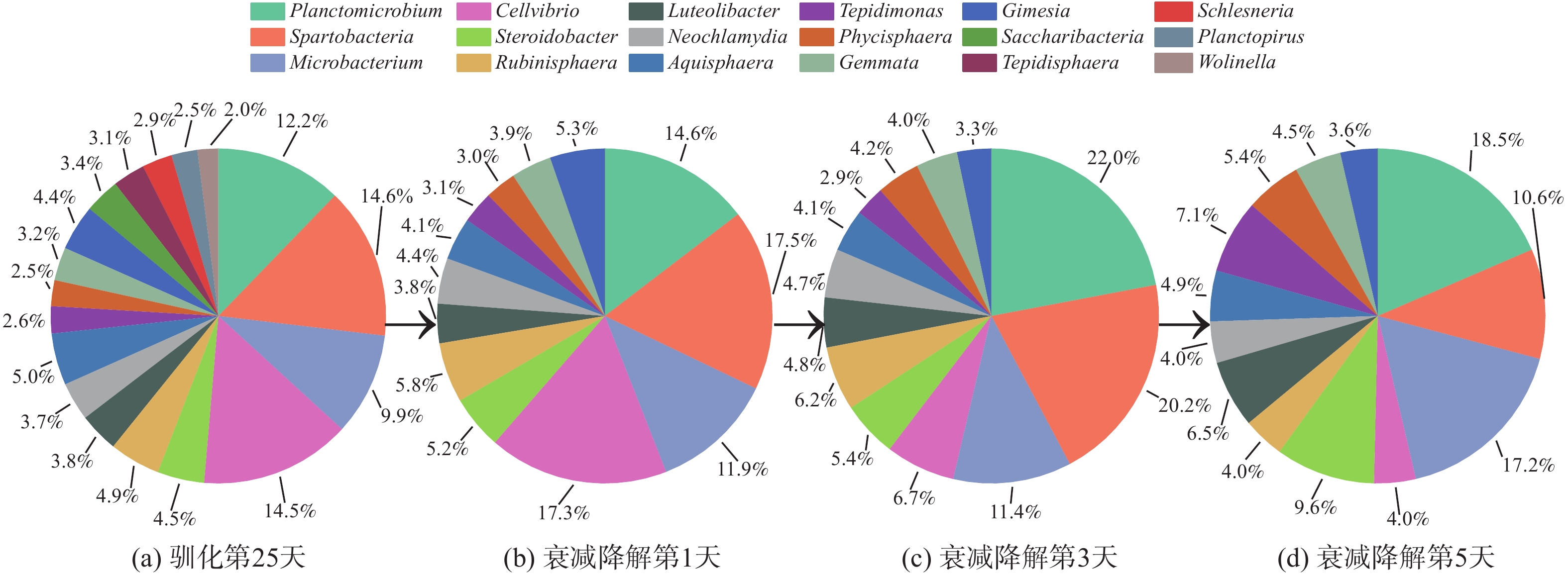
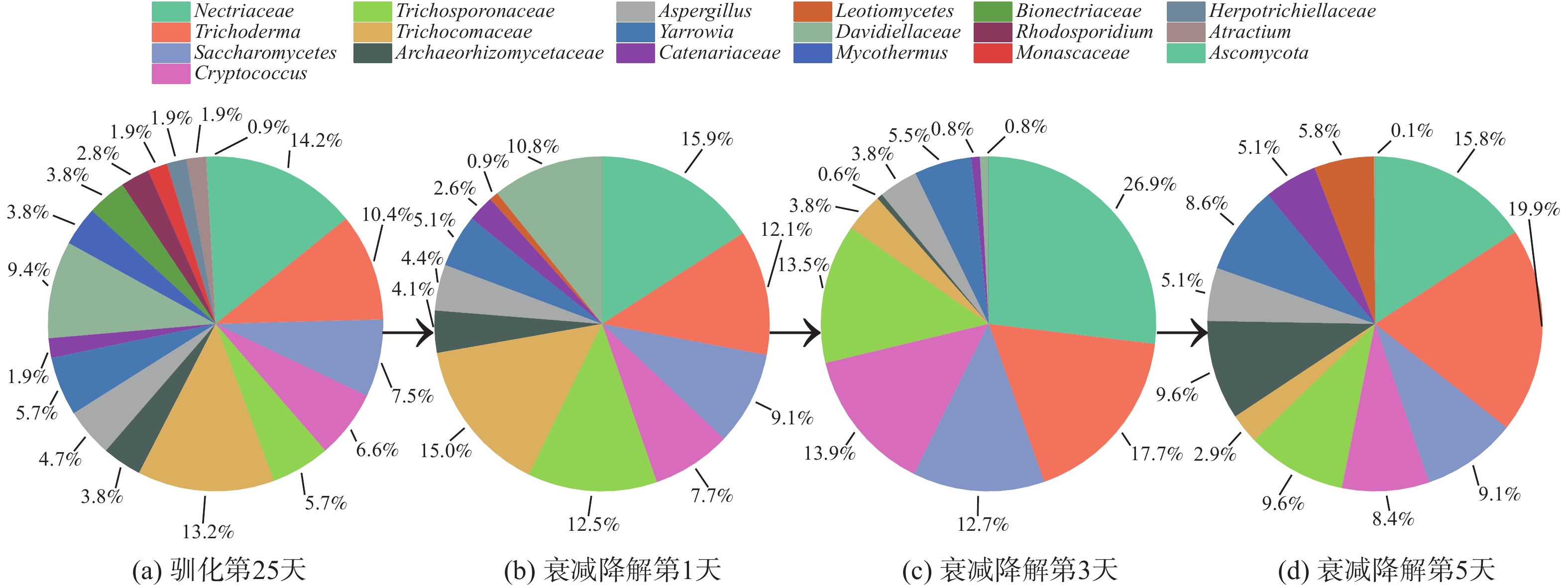
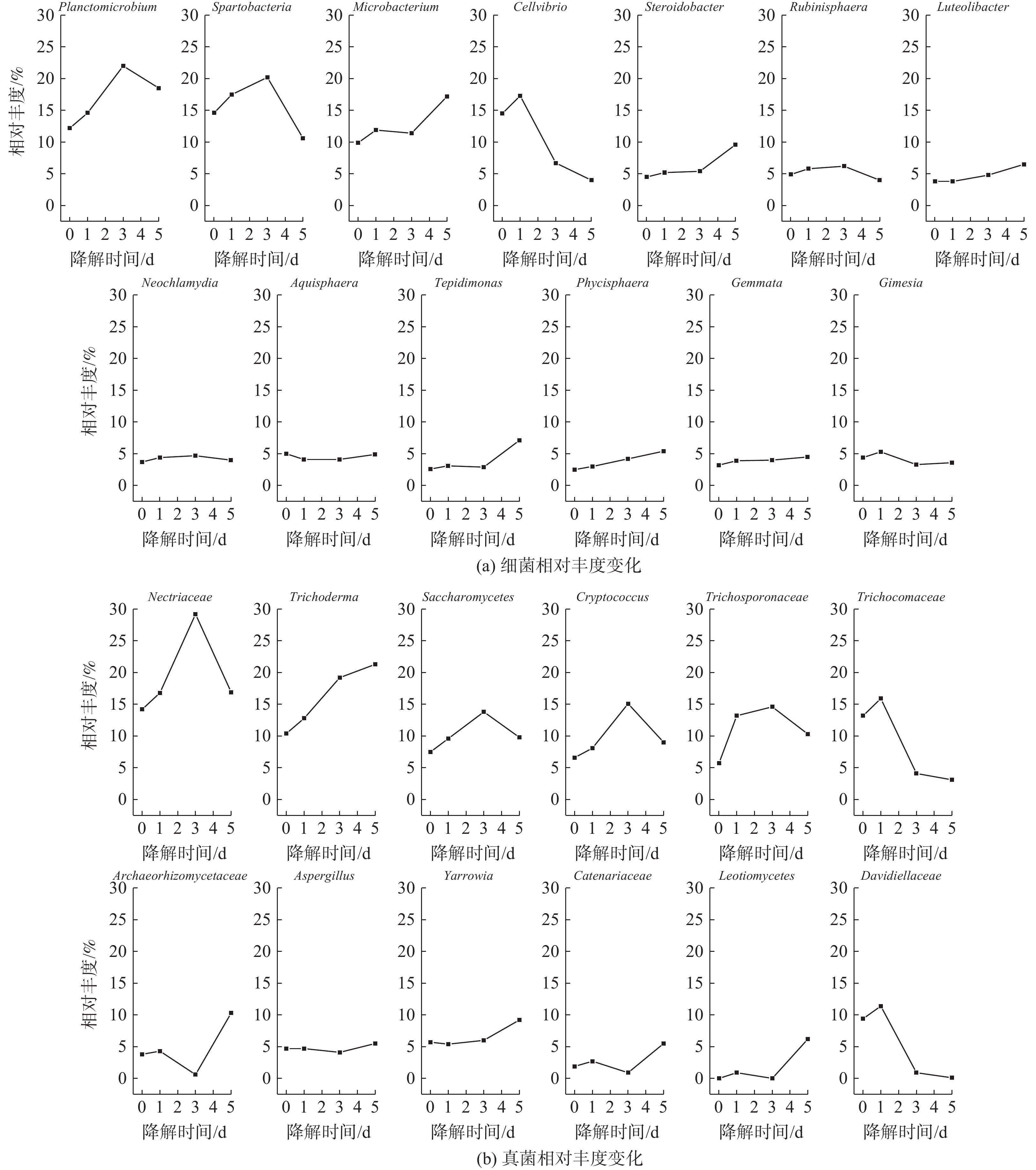
为探索噬油微生物降解油烟VOCs的过程,分别取驯化第25天及衰减实验第1、3、5天的活性污泥样品进行高通量测序分析,获得各样品中微生物菌群组成及丰度数据,进而探讨功能菌群结构的演化(图9~11)。
活性污泥驯化的第25天,在属水平上共检出细菌18种。优势菌属(相对丰度≥5%)为Spartobacteria(14.6 %)、Cellvibrio(14.5 %)、Planctomicrobium(12.2 %)、Microbacterium(9.9 %)、Aqulsphaera(5.0 %)。衰减实验的第1天,细菌种类减至13种,有5种细菌(Saceharibacteria、Tepidisphaera、Schlesneria、Planctopirus、Wolinella)消失。在衰减实验的5 d中,活性污泥细菌种类保持13种,Spartobacteria、Planctomicrobium和Microbacterium一直是群落中的优势菌种,而Cellvibrio的优势地位逐渐被Steroidobacter取代。
活性污泥驯化的第25天,在属水平上共检出真菌18种。优势菌种(相对丰度≥5%)有Nectriaceae(14.2%)、Trichocomaceae(13.2%)、Trichoderma(10.4%)、Davidiellaceae(9.4%)、Saccharomycetes(7.5%)、Cryptococcus(6.6%)、Trichosporonaceae(5.7%)和Yarrowia(5.7%)。衰减实验的第1天,真菌种类减至12种;有7种真菌消失(Mycothermus、Bionectriaceae、Rhodosporidium、Monascaceae、Herpotrichiellaceae、Atractium、Ascomycota);新增1种真菌Leotiomycetes(0.9%);8种优势菌种除Yarrowia(5.1%)相对丰度降低外,其余7种优势菌种相对丰度均有所增长。衰减实验的第3天,真菌种类减至11种;真菌Leotiomycetes消失,Trichocomaceae(3.8%)和Davidiellaceae(0.8%)失去优势地位;新的6种优势菌依次为Nectriaceae(26.9%)、Trichoderma(17.7%)、Cryptococcus(13.9%)、Trichosporonaceae(13.5%)、Saccharomycetes(12.7%)、Yarrowia(5.5%)。衰减实验的第5天,真菌Leotiomycete再次出现,其种类变为12种,相对丰度分布更为均匀,组成菌群的优势菌种类增多;10种优势菌种依次为Trichoderma(19.9%)、Nectriaceae(15.8%)、Trichosporonaceae(9.6%)、Archaeorhizomycetaceae(9.6%)、Saccharomycetes(9.1%)、Yarrowia(8.6%)、Cryptococcus(8.4%)、Leotiomycetes(5.8%)、Aspergillus(5.1%)、Catenariaceae(5.1%)。
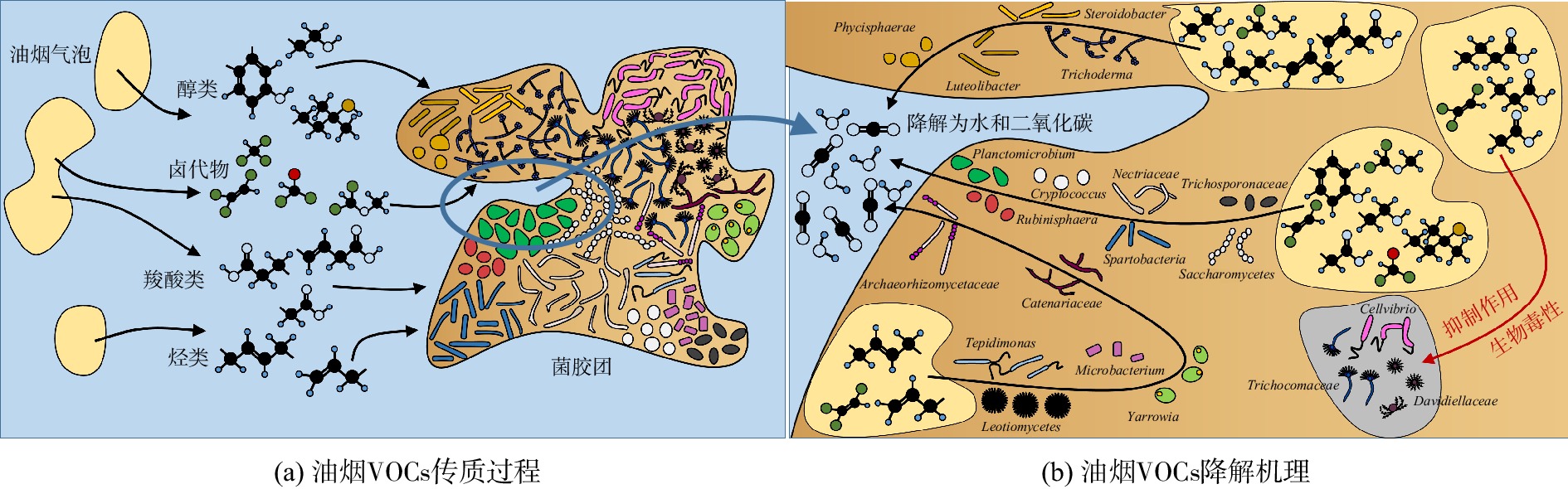
衰减实验中活性污泥微生物菌群的相对丰度变化及液相降解机理如图11和图12所示。细菌属中的Steroidobacter、Luteolibacter和Phycisphaera及真菌属中的Trichoderma在衰减降解的5 d中相对丰度一直增加。这说明这些细菌能通过参与代谢各种油烟污染物而不断增殖;而细菌属中的Planctomicrobium、Spartobacteria和Rubinisphaera及真菌属中的Nectriaceae、Saccharomycetes、Cryptococcus和Trichosporonaceae在衰减降解前3天相对丰度不断增大,在第4~5天相对丰度迅速下降。这表明这类微生物以醇类、羧酸类、二氯甲醚及二氯化乙烯为主要代谢物质(图8)。当第3天这类物质代谢完全后,此类微生物迅速下降或消亡。细菌属中Microbacterium、Tepidimonas及真菌属中的Archaeorhizomycetaceae、Yarrowia、Catenariaceae和Leotiomycetes在衰减降解的前3天相对丰度变化不同,但在第4~5天相对丰度明显上升,这表明该类菌株对烃类物质有很好的转化和降解效果(图8)。
细菌属中的Cellvibrio以及真菌属中的Trichocomaceae和Davidiellaceae在衰减降解实验第1天相对丰度略有上升,之后在第2~5天相对丰度急剧下降,这表明该类菌株易受一些代谢中间产物的抑制作用,适应性较差,对液相中油烟VOCs代谢作用贡献小。抑制作用的产生可能有两方面原因。1)己酸对酵母细胞存在毒害作用:少量己酸即会明显抑制酵母细胞的生长和代谢活动[27];庚酸和辛酸会抑制厌氧污泥微生物的代谢活性,并通过破坏微生物细胞膜结构而杀死微生物[28],被称为厌氧污泥微生物的杀菌性毒素[29];这3种微生物可能对于长链羧酸的毒性较为敏感,导致其代谢活动减少或被杀死,从而表现出菌群相对丰度降低。2)洗涤液中的氯代烃同样对微生物存在抑制作用:氯代烃会破坏微生物细胞膜[30],且在氯代烃降解过程中产生的次氯酸类化合物具有类似毒性[31];其中,三氯乙烯始终存在于衰减降解过程中,其浓度较高时会明显抑制微生物的数量和多种酶的活性[32]。长链羧酸(在衰减降解实验第2~3天,浓度急剧下降至检测不出)和三氯乙烯(在衰减降解实验第2~3天,浓度急剧升高,在衰减降解实验第4~5天,浓度虽有下降但也维持在较高浓度)的质量分数变化也与3种微生物的相对丰度变化趋势一致,即在衰减降解实验第2~3天相对丰度急剧下降,后2 d相对丰度下降趋势放缓。
由于三氯乙烯始终未被完全降解,且其本身对微生物具有毒性,故活性污泥洗涤法无法有效降解三氯乙烯。而在整个过程中,细菌属中Neochlamydia、Aquisphaera、Gemmata和Gimesia及真菌属中Aspergillus的相对丰度始终较低,无法有效利用油烟污染物来进行大量繁殖,故其在降解过程中所起作用仍待考证。因此,在液相油烟污染物代谢过程中起主导作用的微生物菌株有细菌属的Planctomicrobium、Spartobacteria、Microbacterium、Steroidobacter、Rubinisphaera、Luteolibacter和Phycisphaera,以及真菌属的Nectriaceae、Trichoderma、Saccharomycetes、Cryptococcus、Trichosporonaceae、Archaeorhizomycetaceae和Yarrowia。
-
1)经过25 d驯化后,活性污泥的MLSS为3.10 g·L−1,MLVSS为1.60~1.90 g· L−1, SV、SVI分别为35%和120 mL·g−1。该污泥对餐饮油烟中烯醛类、醇类、烷烃类、酯类的洗涤效率达到95%以上,对己醛和庚醛的洗涤效率为91%和86%。而该污泥对辛醛、壬醛、癸醛、2,2-亚甲基双-(4-甲基-6-叔丁基苯酚)的洗涤效率仅有66%、59%、52%、55%,说明这些物质较难被洗涤去除。另外,一些VOCs被洗涤至液相,使得驯化后活性污泥洗涤液中有机物种类和质量分数增大;而另一些组分的质量分数出现下降,其中个别组分被完全降解。
2)活性污泥液相油烟衰减实验中共检出18种有机物化合物。其中,有14种化合物在第1~3天被微生物完全降解;而在第4~5天,十五烷、8-十七烷烯、17-三十五碳烯被完全降解,仅剩三氯乙烯仍保持较高含量。
3)高通量测序分析表明,降解液相油烟污染物的主要微生物为细菌属Planctomicrobium、Spartobacteria、Microbacterium、Steroidobacter、Rubinisphaera、Luteolibacter和Phycisphaera,以及真菌属Nectriaceae、Trichoderma、Saccharomycetes、Cryptococcus、Trichosporonaceae、Archaeorhizomycetaceae、Yarrowia。微生物种类及相对丰度受液相油烟VOCs组分及降解反应持续时间的影响。
活性污泥洗涤净化餐饮油烟VOCs及其生物降解过程
Prificaion of VOCs in cooking fume by activated sludge washing and its biodegradation process
-
摘要: 将活性污泥驯化25 d后,考察了其性能及其在洗涤净化餐饮油烟VOCs过程中气液组成与微生物群落的变化。结果表明:驯化后活性污泥的MLSS稳定在3.10 g·L-1,MLVSS稳定在1.60~1.90 g·L-1,SV、SVI分别稳定在35 %和120 mL·g-1;在此条件下,洗涤净化系统对油烟的洗涤效率稳定在85%;系统对油烟中烯醛类、醇类、烷烃类、酯类的洗涤效率达到95 %以上,仅对部分直链醛类的洗涤效果较差;驯化前活性污泥中有机物以氯代物和长链烷烃为主,而驯化后酯类成为新增主要成分。此外,活性污泥液相油烟衰减实验共检出18种有机物化合物。其中,14种有机物在第1~3天降解期内被微生物降解完全;在第4~5天内,十五烷、8-十七烷烯、17-三十五碳烯被完全降解,仅剩三氯乙烯仍保持较高的含量。高通量测序分析结果表明:液相油烟VOCs降解过程中起主要代谢作用的微生物为Planctomicrobium、Spartobacteria、Microbacterium、Steroidobacter、Rubinisphaera、Luteolibacter、Phycisphaera细菌属和Nectriaceae、Trichoderma、Saccharomycetes、Cryptococcus、Trichosporonaceae、Archaeorhizomycetaceae、Yarrowia真菌属;微生物种类及相对丰度受液相油烟VOCs组分影响,且随降解反应的进行而变化。本研究可为生物洗涤法处理餐饮油烟的技术应用提供参考。Abstract: In this paper, the changes of gas-liquid composition and microbial community in the process of washing and purifying restaurant cooking fume VOCs after acclimation of activated sludge for 25 days were studied. The results showed that the MLSS of activated sludge after acclimation was stable at 3.10 g·L−1, MLVSS was stable at 1.60~1.90 g·L−1, SV and SVI were stable at 35% and 120 mL·g−1, respectively. Under these conditions, the washing efficiency of lampblack was stable at 85%, the washing efficiency of enaldehydes, alcohols, alkanes and esters in lampblack reached more than 95%, and only the washing efficiency of some straight-chain aldehydes was low.The organic matter in the activated sludge before domestication was mainly composed of chlorinated substances and long-chain alkanes., while esters became the main components after domestication. In addition, 18 kinds of organic compounds were detected during the liquid phase lampblack attenuation test of activated sludge, 14 organic compounds were completely degraded by microorganisms within the degradation period of 1 to 3 days; pentadecane, 8-heptadecanene, and 17-35carbene were completely degraded within 4 to 5 days, and only trichloroethylene still remained at a high content. High-throughput sequencing analysis indicated that the main metabolizing microorganisms in the degradation process of VOCs in liquid oil smoke were Planctomicrobium, Spartobacteria, Microbacterium, Steroidobacter, Rubinisphaera, Luteolibacter, Phycisphaera and Nectriaceae, Trichoderma, Saccharomycetes, Cryptococcus, Trichosporonaceae, Archaeorhizomycetaceae, Yarrowia. The species and abundance of microorganisms were affected by VOCs components of liquid oil fume and varied with the degradation reaction. This study can provide reference for the application of biological washing method to treat cooking fume.
-
Key words:
- cooking fume /
- multicomponent VOCs /
- bioscrubbing /
- activated sludge /
- biodegradation
-

-
-
[1] WANG H, XIANG Z, WANG L, et al. Emissions of volatile organic compounds (VOCs) from cooking and their speciation: A case study for Shanghai with implications for China[J]. Science of the Total Environment, 2017, 621: 1300-1309. [2] 冯铁成, 易红宏, 唐晓龙, 等. 餐饮油烟污染及其净化技术研究进展[J]. 现代化工, 2017, 37(3): 20-23. [3] KUMAR A, SINGH D, KUMAR K, et al. Distribution of VOCs in urban and rural atmospheres of subtropical India: Temporal variation, source attribution, ratios, OFP and risk assessment[J]. Science of the Total Environment, 2018: 492-501. [4] HAN D, WANG Z, CHENG J, et al. Volatile organic compounds (VOCs) during non-haze and haze days in Shanghai: characterization and secondary organic aerosol (SOA) formation[J]. Environmental Science and Pollution Research, 2017, 24(22): 18619-18629. doi: 10.1007/s11356-017-9433-3 [5] YIN Z, LI H, CUI Z, et al. Polymorphisms in pre-miRNA genes and cooking oil fume exposure as well as their interaction on the risk of lung cancer in a Chinese nonsmoking female population.[J]. OncoTargets and Therapy, 2016, 9(1): 395-401. [6] 何万清, 王天意, 邵霞, 等. 北京市典型餐饮企业大气污染物排放特征[J]. 环境科学, 2020, 41(5): 2050-2056. [7] 程婧晨, 崔彤, 何万清, 等. 北京市典型餐饮企业油烟中醛酮类化合物污染特征[J]. 环境科学, 2015, 36(8): 2743-2749. [8] 王红丽, 景盛翱, 楼晟荣, 等. 餐饮行业细颗粒物( PM2.5 )排放测算方法: 以上海市为例[J]. 环境科学, 2018, 39(5): 1971-1977. [9] 林立, 何校初, 邬坚平, 等. 上海餐饮油烟污染特征研究[J]. 环境科学与技术, 2014, 37(S2): 546-549. [10] 童梦雪, 李勤勤, 赵紫微, 等. 深圳市餐饮油烟醛酮类化合物污染特征研究[J]. 环境科学学报, 2019, 39(12): 4196-4206. [11] 蒋燕, 尹元畅, 王波, 等. 成都市川菜烹饪油烟中VOCs排放特征及其对大气环境的影响[J]. 环境化学, 2014, 33(11): 2005-2006. doi: 10.7524/j.issn.0254-6108.2014.11.025 [12] 刘芃岩, 马傲娟, 邱鹏, 等. 保定市餐饮源排放PM2.5中有机污染物特征及来源分析[J]. 环境化学, 2019, 38(4): 770-776. doi: 10.7524/j.issn.0254-6108.2018091602 [13] 王程塬. 兰州市餐饮油烟污染排放治理技术研究[D]. 兰州: 兰州大学, 2015. [14] 李源遽, 吴爱华, 童梦雪, 等. 餐饮源有机颗粒物排放特征[J]. 环境科学, 2020, 41(8): 3467-3474. [15] 崔彤, 程婧晨, 何万清, 等. 北京市典型餐饮企业VOCs排放特征研究[J]. 环境科学, 2015, 36(5): 1523-1529. [16] 徐敏, 何万清, 聂磊, 等. 传统北京烤鸭烤制过程中大气污染物的排放特征[J]. 环境科学, 2017, 38(8): 3139-3145. [17] TO W M, YEUNG L, CHAO C Y H. Characterisation of gas phase organic emissions from hot cooking oil in commercial kitchens[J]. Indoor and Built Environment, 2000, 9: 228-232. doi: 10.1177/1420326X0000900312 [18] 高雅琴, 王红丽, 许睿哲, 等. 餐饮源挥发性有机物组成及排放特征[J]. 环境科学, 2019, 40(4): 1627-1633. [19] 何万清, 聂磊, 田刚, 等. 基于GC-MS的烹调油烟VOCs的组分研究[J]. 环境科学, 2013, 34(12): 4605-4611. [20] 王红丽, 景盛翱, 乔利平. 餐饮排放有机颗粒物的质量浓度、化学组成及排放因子特征[J]. 环境科学, 2019, 40(5): 2010-2018. [21] LIAO L, LIU H, ZHANG B. Biodegradability of pollutants from cooking fumes[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(4): 428-434. doi: 10.1007/s00128-008-9595-2 [22] 刘超, 廖雷, 魏建文, 等. 不同填料-液相油烟微生物降解动力学研究[J]. 环境科学与技术, 2016, 39(11): 95-100. [23] 贾力强, 廖雷, 刘超. 投加优势菌强化降解液相油烟污染物的动力学研究[J]. 环境工程学报, 2017, 11(2): 1009-1014. doi: 10.12030/j.cjee.201510005 [24] 贾力强, 廖雷, 覃爱苗, 等. 活性污泥洗涤烹饪油烟的传质性能强化[J]. 环境工程学报, 2017, 11(10): 5490-5494. doi: 10.12030/j.cjee.201611037 [25] 周江喜, 廖雷, 吴霁昱, 等. 餐饮油烟污染物成分分析及其洗涤处理研究[J]. 环境工程学报, 2014, 32(3): 79-85. [26] 胡文秀, 廖雷, 贾力强, 等. 生物法净化烹饪油烟营养配比的优化[J]. 工业安全与环保, 2018, 44(12): 63-66. doi: 10.3969/j.issn.1001-425X.2018.12.017 [27] 经艳, 周玉恒, 覃香香, 等. 甘蔗叶汽爆液中挥发性微生物生长抑制物的鉴定[J]. 食品与发酵工业, 2008, 34(11): 29-32. [28] 周洪波, 陈坚, 赵由才, 等. 长链脂肪酸对厌氧颗粒污泥产甲烷毒性研究[J]. 水处理技术, 2002, 28(2): 93-97. doi: 10.3969/j.issn.1000-3770.2002.02.009 [29] 贺延龄. 废水的厌氧生物处理[M]. 北京: 中国轻工业出版社, 1998. [30] 王鑫昕, 王少华, 李维, 等. 细菌的有机溶剂耐受机制[J]. 生物工程学报, 2009, 25(5): 641-649. doi: 10.3321/j.issn:1000-3061.2009.05.001 [31] 何芝. 氯代烃胁迫条件下覆盖土菌群耐受性与群体感应研究[D]. 重庆: 重庆理工大学, 2017. [32] 李鹏飞. 三氯乙烯对黑土微生物的生态毒理效应研究[D]. 哈尔滨: 东北农业大学, 2019. -



 下载:
下载: