-
我国城市化进程飞速发展和产业结构改革促使传统化工企业改型,导致城市内及周边存在大量遗留的工业污染场地[1]。多环芳烃 (Polycyclic Aromatic Hydrocarbons, PAHs) 是焦化场地的特征污染物,具有强致癌性、致突变性和致畸性[2],严重威胁生态环境和人体健康。PAHs污染土壤的物理修复技术中,电阻加热技术 (electrical resistance heating, ERH) 因修复效率高、对场地异质结构适应性高而被广泛应用[3]。ERH处理温度最高约为100~120 ℃[3-4],该温度下能耗高,土壤微生物生长和活性受限[3, 5],不利于土壤后续利用。因此,需要降低ERH加热温度,减小对土壤功能性的损害。
据统计,1988-2021年全球土壤热修复项目中,有57.2%的项目采用ERH技术[6],其中低温ERH应用广泛。35~50 ℃的低温ERH用于与原位生物修复、零价铁 (ZⅥ) 还原等技术联合修复氯化溶剂污染源区,研究结果显示升温提高降解反应速率、增大污染物溶解度并促进挥发作用,将温度从5 ℃提高至60 ℃,重质非水相有机污染物的质量转移率提高了4~5倍,联合修复能够提升修复效率、提高修复效果、降低成本[7]。常规加热温度由20 ℃升至80 ℃过程中,土壤细菌总量和污染物溶解度大幅增加,土壤优势菌群发生改变,污染物的生物利用度和降解率提高,60 ℃下总PAHs去除率比20 ℃下提高了21.01%,75 ℃下萘的溶解度比20 ℃下增加约10倍[8-11];恒定电场强度、较长时间尺度下 (≥180 min) 土壤热处理影响微生物群落,使其多样性、均匀度降低,并改变优势种,但恒定电场强度下加热温度波动大,无法研究恒定加热温度对微生物的影响[5, 12-13]。
对于低温ERH在恒定温度下处理PAHs污染土壤过程中对土壤肥力和细菌群落结构的影响研究较缺乏。本研究以PAHs原位污染土壤为研究对象,拟采用实验室自制电阻加热装置研究低温ERH (80 ℃) 处理180 min下污染土壤PAHs的去除率和对土壤理化性质、土壤细菌数量、群落结构和PAHs降解菌丰度的影响,研究结果可为多环芳烃污染土壤的电阻加热修复提供理论指导。
-
实验土壤采自济南钢铁厂焦化污染场地表层土壤 (0~50 cm) ,低温条件下 (4 ℃) 运至实验室,去除石块、树枝后取50 g封存于自封袋内,作为未加热处理的土壤样品 (CK) ,存于−20 ℃冰箱,用于测定微生物指标。将剩余土壤风干、过筛,经混料机混匀24 h,分取部分待测土壤理化性质 (pH、总碳、总氮、有机碳、全磷和全钾) 和PAHs质量分数。供试土壤的基本性质为,pH 8.36,总碳质量分数1.74%,总氮质量分数0.07%,有机碳质量分数0.86%,全磷质量分数0.06%,全钾质量分数0.80%,土壤∑16 PAHs质量分数28.3 mg·kg−1。
-
2-氟联苯标准品 (C12H9F, 99.7%)、对三联苯标准品 (C18H14, 99.6%)、氘代苊标准品 (C12D10, 99.0%)、氘代屈标准品 (C18D12, 99.0%)、萘-d8标准品 (C10D8, 99.9%)、二萘嵌苯-d12标准品 (C20D12, 99.4%)、菲-d10标准品 (C14D10, 98.6%);氯化钠 (NaCl, 分析纯) ;正己烷 (C6H14)、二氯甲烷 (CH2Cl2)、丙酮 (CH3COCH) 均为色谱纯。
自制电阻加热小试装置 (图1) 由多路平行的电阻加热筒体、电极片、抽提装置、补水装置和集中控制屏等部分组成;气相色谱质谱联用仪 (7890-7000B,美国安捷伦科技公司) ;加速溶剂萃取仪 (Dionex ASE 350,赛默飞世尔科技有限公司) ;冷冻干燥机 (FD-1C-50,北京博医康实验仪器有限公司) ;混匀机 (SCI-FS,美国赛洛捷克仪器有限公司);实时荧光定量仪 (LightCycler480II,罗氏诊断产品 (上海) 有限公司) ;微量分光光度计 (NanoDrop 2000,赛默飞世尔科技有限公司) 。
-
实验共2个处理,未加热处理 (CK) 和电阻加热处理 (ERH),每个处理设置3个重复。ERH处理为将土壤 (800 g风干土调至30%含水率和0.5%含盐率) 置于自制反应罐中,电场强度为6 V·cm−1,加热温度80 ℃,加热时间180 min (包括加热前10 min由室温升至80 ℃的升温阶段和之后80 ℃的恒温阶段,不包括降温阶段) ,加热期间不补水。
加热处理结束后,迅速取样作为ERH处理后的土壤样品。首先,分取10 g土壤于离心管中,储存于−20 ℃冰箱,用于提取土壤DNA;另取100 g土壤,风干后用于测定土壤理化性质;再取50 g土壤,冷冻干燥处理24 h后储存于4 ℃冰箱,待测PAHs质量分数。
-
1)土壤理化性质分析方法。采用电位法[14]测定土壤pH;采用元素分析法[15]测定土壤总氮和总碳质量分数;采用重铬酸钾分光光度法[16]测定有机碳质量分数;采用钼锑抗比色法[17]测定全磷质量分数;采用火焰光度法[18]测定全钾质量分数。
2)土壤PAHs质量分数分析。采用加速溶剂萃取 (ASE 350) 提取土样中的PAHs,采用气相色谱质谱联用仪 (7890-7000B) 定量分析。仪器配备DB-5MS色谱柱 (30 m×0.25 mm×0.25 μm);色谱柱升温程序[19]:以初始值80 ℃保持2 min,再以20 ℃·min−1 速度升至180 ℃并保持5 min,后以20 ℃·min−1 速度升至290 ℃并保持6 min;载气:高纯氦气,载气流速:1 mL·min−1;进样方式:不分流;进样量:1.0 μL。
3)土壤DNA提取及纯化:样品DNA提取及纯化按照Omega Mag-Bind Soil DNA Kit (M5635-02)说明书进行操作。DNA纯度和浓度利用NanoDrop ND2000微量分光光度计检测。收集的DNA储存于−20 ℃冰箱,用于实时定量PCR和高通量测序。
4) 16S rRNA基因定量和高通量测序:16S rRNA基因定量和V3~V4区高通量测序分别在实时荧光定量PCR仪和NovcaSeq PE250测序平台进行,使用引物338F (5’-ACTCCTACGGGAGGCAGCAR-3’) 和806R (5’-GGACTACHVGGGTWTCTAAT-3’)[20]。序列分析使用QIIME 2[21]分析平台,使用DADA2去除引物、质量过滤、去噪、拼接以及去除嵌合体[22]获得特征序列ASVs[23],最后采用Fasttree2[24]软件构建系统发育树。
5)数据分析方法。PAHs去除率计算如式(1)所示。
式中:R为污染物 (PAHs) 的去除率,%;
$ {c}_{0} $ 为污染物 (PAHs) 的初始质量分数,mg·kg−1;$ {c}_{t} $ 为加热处理t时间后污染物 (PAHs) 的残留质量分数,mg·kg−1。 -
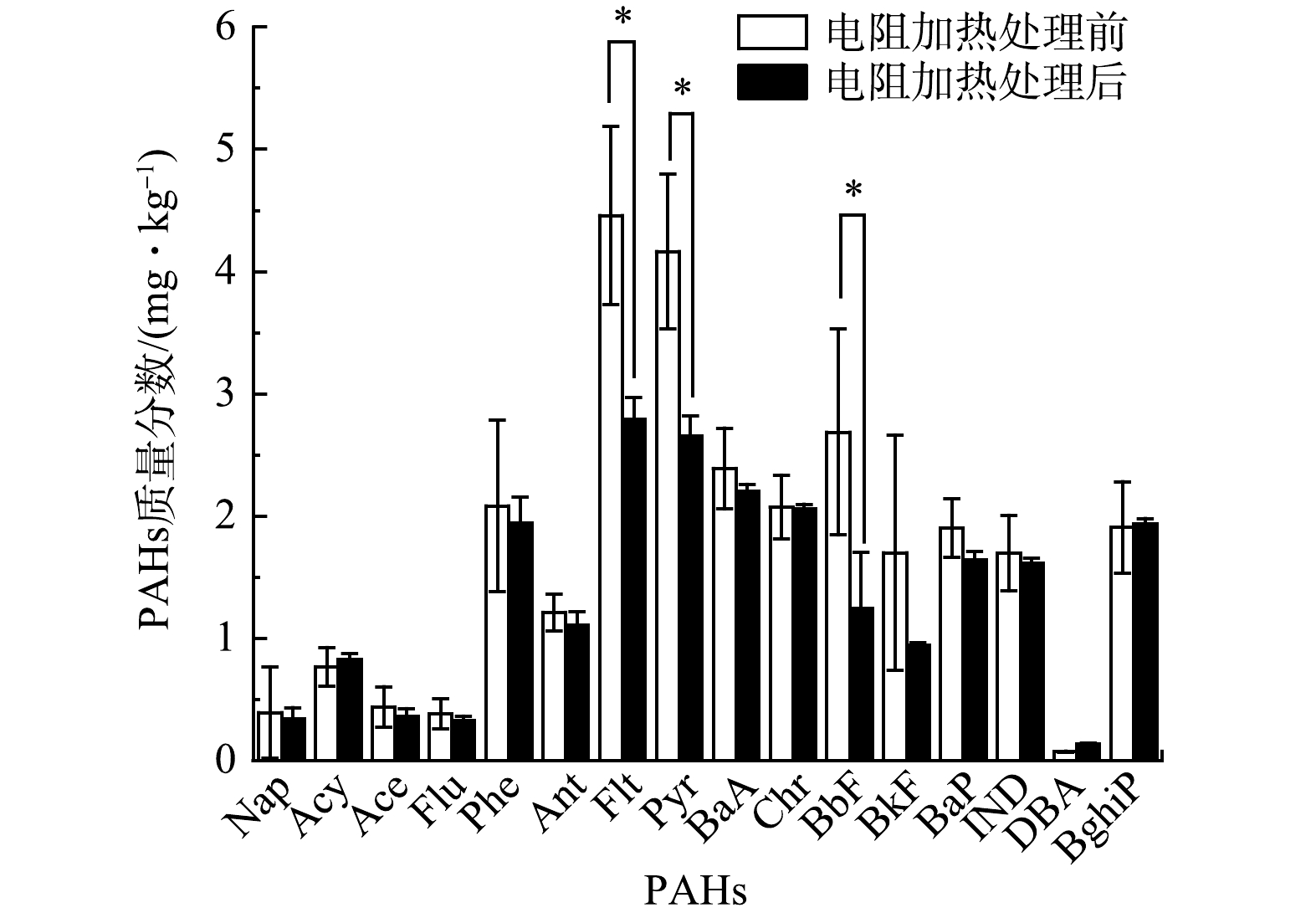
低温热处理前后土壤中PAHs质量分数如图2所示。结果表明,处理后土壤中总PAHs质量分数由28.3 mg·kg−1降至22.1 mg·kg−1。其中,原始土壤中质量分数最高的Benzo(k)fluoranthene (BkF) 质量分数由4.46 mg·kg−1降至2.79 mg·kg−1。处理后苯并[a]蒽、苯并[b]荧蒽、苯并[k]荧蒽、䓛、二苯并[a,h]蒽、茚并[1,2,3-cd]芘和萘的质量分数均低于《土壤环境质量建设用地污染风险管控标准 (试行) 》(GB 36600-2018)[25]第一类用地筛选值。
低温热处理下总PAHs的去除率为21.8%,Flt, Pyr, BbF和BkF的去除率较高,为36%~54%,其余12种PAHs去除率均低于18%。ERH对Flt (4环)、Pyr (4环)、BbF (5环) 和BkF (5环) 的去除率高可能是由于这4种PAHs在原始土壤中质量分数高。有研究显示,土壤中PAHs去除率与其质量分数极显著相关[26]。此外,PAHs去除率还与分子量有关。低温热处理下不同环数PAHs的去除具有规律性,2~3环PAHs的去除率低于4~5环PAHs,6环PAHs去除率最低。FALCIGLIA等[27]研究表明,PAHs在加热条件下的去除与污染物沸点、极性和分子结构密切相关。由于高分子量PAHs (HMW-PAHs, 4~6环PAHs,共10种[28]) 具有复杂结构而非线性PAHs,较低分子量PAHs (LMW-PAHs, 2~3环PAHs,共6种) 沸点高,热化学性质更稳定,更难加热挥发和生物降解[29],6环PAHs沸点最高,分子结构最复杂,因此在80 ℃下去除率最低;但2~3环PAHs去除效果不如4~5环PAHs,这可能是由于加热过程中发生了PAHs的固体热裂解和气体合成反应,故导致不同环数PAHs质量分数的波动[29],且180 min的加热时间较短,不足以去除反应生成的2~3环PAHs。
-
ERH处理前后土壤的pH、总碳、总氮、有机碳、全磷和全钾质量分数变化如表1所示。其中,低温热处理后土壤pH降低,是由于有机物氧化过程中有机酸的分解和碱阳离子的释放引起的[30];处理前后土壤肥力水平的重要指标,即有机碳质量分数[31]无统计学差异,是由于低温加热条件 (<100 ℃)对有机碳质量分数的影响可忽略[5]。此外,反应土壤养分的指标,即土壤全磷和全钾质量分数[32]均无显著差异,说明本研究加热条件下ERH处理去除污染物的同时不会对土壤肥力和养分水平造成负面影响。
-
1) 土壤细菌丰度和α多样性。低温热处理后细菌丰度和α多样性如表2所示,低温热处理增大了土壤中细菌丰度,16S rRNA基因拷贝数由0.12×108 copies·g−1增加至0.25×108 copies·g−1。ERH处理通过降低土壤污染物质量分数和改变土壤理化性质,进而影响土壤细菌丰度。本研究中,低温热处理后原始土壤中21.8%的总PAHs被去除,较低的pH和高可利用性碳质量分数利于细菌生长繁殖[33],污染物胁迫降低和更多可利用的营养物质可能是细菌丰度升高的原因[30]。此外,也可能因为草酸等有机酸和相关土壤酶的增加改善了细菌的生长环境或提供了细菌生长所需物质,从而间接导致细菌丰度升高[34]。
本研究涉及的多样性指标中,Chao1指数和Observed species指数代表群落丰富度,2者数值与群落丰富度呈正相关;Shannon和Simpson指数代表群落多样性,2者数值与群落多样性呈正相关。其中,Shannon指数更适用于复杂群落,Simpson更适用于简单群落[35]。由表2可知,Chao1、Observed species和Shannon指数上升,Simpson指数没有明显的变化。低温热处理下细菌丰度升高,物种数增加,进而促使群落的丰富度和多样性的增加,是由于温度升高会促进嗜热菌的生长,该结果与DONG等[34]和VAN等[11, 36]一致。
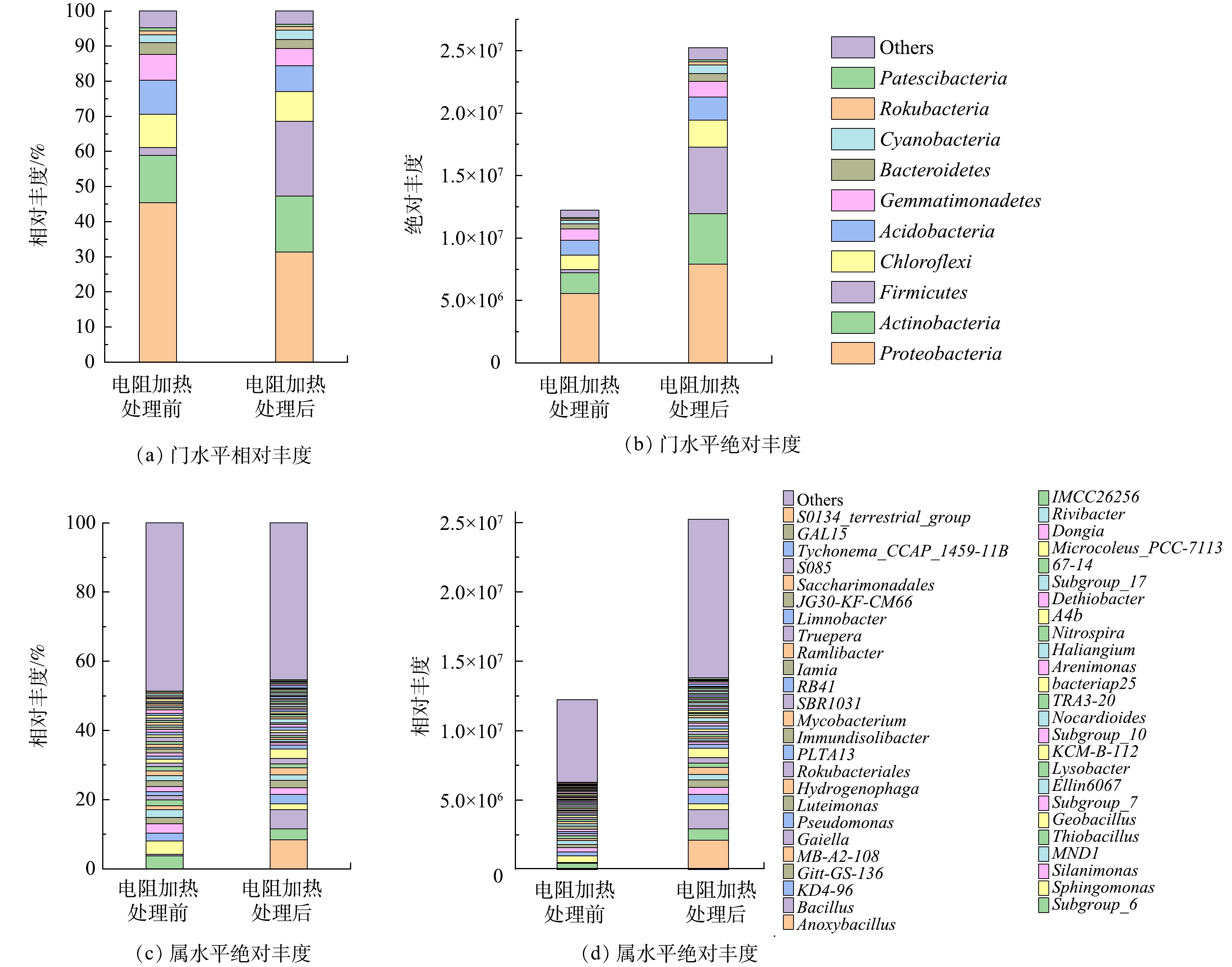
2) 土壤细菌分类学组成。图3(a)和图3(b)是门水平Top10菌的相对丰度和绝对丰度。原始土壤中相对丰度和绝对丰度最高的菌属于变形菌门 (Proteobacteria),丰度分别为45.42%和5.56×106 copies·g−1。低温ERH处理下放线菌门 (Actinobacteria)、厚壁菌门 (Firmicutes)和蓝菌门 (Cyanobacteria)的丰度均升高,表明高温胁迫会引起放线菌门和厚壁菌门的相对丰度增加[37]。低温ERH处理将厚壁菌门PAHs降解菌的相对丰度放大了近10倍,由2.21%增加至21.2%,厚壁菌门细菌能适应高温,SUN等[38]同样发现加热处理使土壤中潜在PAHs降解菌厚壁菌门的总数增加了0.11~0.72个数量级。变形菌门 (Proteobacteria),绿弯菌门 (Chloroflexi),酸杆菌门 (Acidobacteria),芽单胞菌门 (Gemmatimonadetes),拟杆菌门 (Bacteroidetes),己科河菌门 (Rokubacteria)和超级细菌门 (Patescibacteria) 丰度在低温ERH处理后降低,是由于低温ERH处理下耐热、耐电场和PAHs降解菌数量增多,导致以上7个菌门的相对丰度降低,此外,大部分细菌在80 ℃环境下难以存活,数量降低,也会导致其相对丰度降低[39]。
图3(c)和图3(d)是属水平Top50菌属的相对丰度和绝对丰度。其中,原始土壤中相对丰度和绝对丰度最高的菌属为Sphingomonas,丰度分别为3.92%和4.8×105 copies·g−1。低温ERH处理使Anoxybacillus, Bacillus, KD4-96, Gitt-GS-136, MB-A2-108, Gaiella, Geobacillus, PLTA13, Nocardioides, Haliangium, Limnobacter, 67-14, Tychonema_CCAP_1459-11B, Dongia和IMCC26256的丰度均升高,其中,Gaiella, Bacillus, Nocardioides, Bacillus和Geobacillus等为PAHs降解菌[40-46]。此外,低温ERH对PAHs降解菌Geobacillus以及Bacillus的富集作用尤其强,其相对丰度的增幅分别为2.66%和5.04%。Geobacillus和Bacillus同属厚壁菌门芽孢杆菌纲,代谢快,繁殖迅速,且对不利条件具有强抵抗力[47]。
3) 土壤细菌群落组成及关键影响因子。
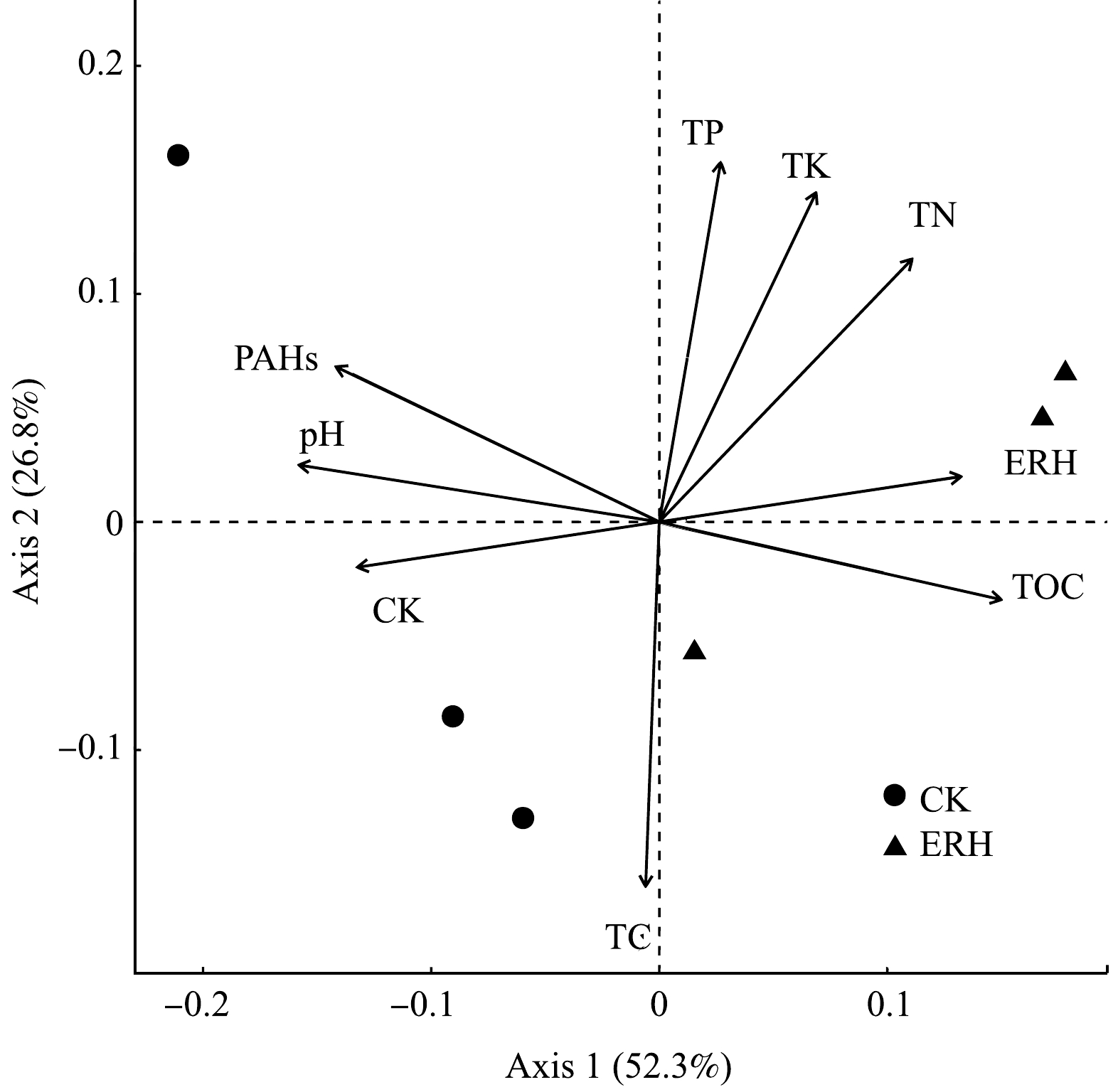
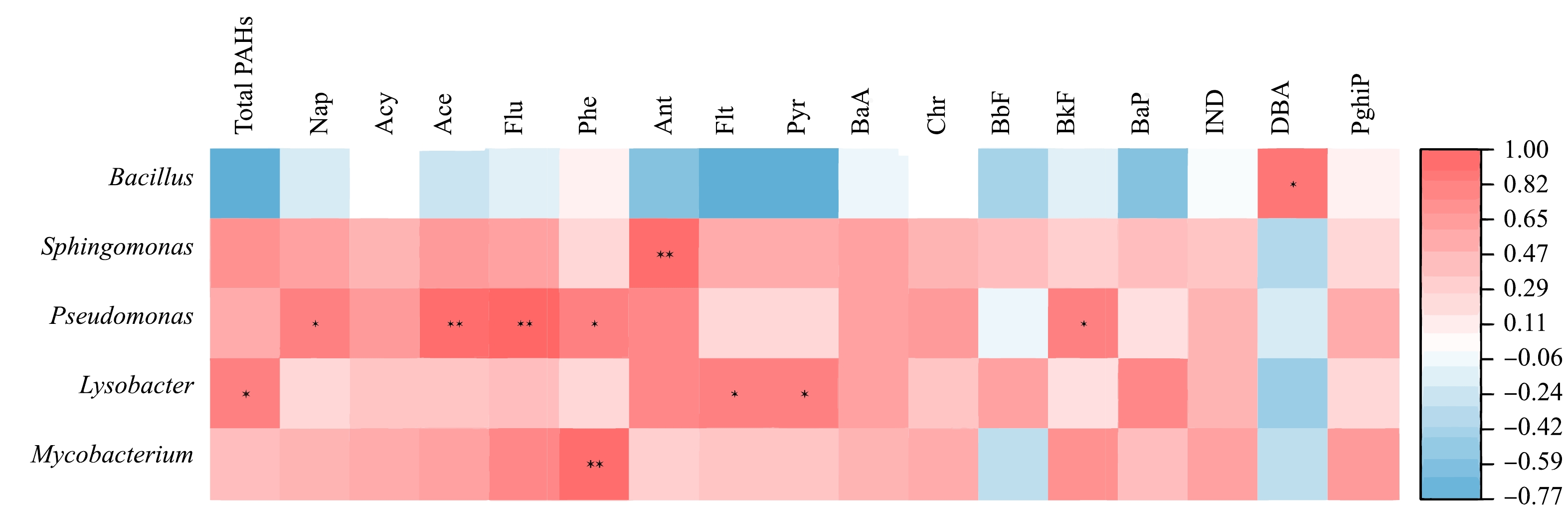
基于Bray Curtis矩阵距离的PCoA分析与基于回归函数envfit进行的检验结果如图4所示,结果显示,PCo1和PCo2分别解释细菌群落结构差异的52.3%和26.8%,累计解释率高达79.1%,可以充分解释数据中的大部分变化。低温热处理前后土壤中细菌群落组成在PCoA图中分离,说明低温热处理改变了原始土壤中细菌群落构成。检验结果显示,土壤PAHs与细菌群落结构呈显著正相关 (r2=0.98, P<0.05),说明土壤PAHs质量分数是影响细菌群落结构的关键因素。通过PAHs降解菌丰度和土壤PAHs质量分数的相关性分析,由图5可知,Bacillus, Sphingomonas, Pseudomonas, Lysobacter和Mycobacterium均与一种或多种PAHs质量分数呈显著正相关 (p<0.05),由此推断土壤PAHs通过影响PAHs降解菌丰度进而影响细菌群落结构。
此外,温度和电场强度通过影响细菌丰度、群落丰富度和多样性,进而对细菌群落结构产生不同程度的影响[48],高温和电场共同胁迫下,对胁迫敏感的细菌种群丰度下降,对胁迫耐受的细菌种群丰度升高[36, 49]。具体而言,加热处理下,对生存环境变化敏感的细菌种群丰度会发生明显变化,其中一部分细菌种群丰度下降甚至消失,相反,耐热细菌因受到环境条件的刺激,种群丰度上升[36];电场影响下,对电场胁迫不耐受的细菌种群丰度下降,而如Firmicutes菌门等具有特殊细胞壁结构、能适应交流电对细胞膜磷脂结构破坏性的细菌丰度上升。
4) 多环芳烃降解功能基因预测丰度。PICRUSt2分析预测了来自16S rRNA序列数据的微生物群落潜在功能基因,共鉴定出192条KEGG通路。图6所示为已报道的17个能够降解PAHs的功能基因在低温热处理前后的土壤中的预测丰度值,研究还指出PAHs降解功能基因的丰度反映PAHs污染土壤中生物降解的潜力和活性。低温热处理后丰度升高的有编码原儿茶酸盐3,4-二氧酶 (β亚单位) (K00448) 、4,5-二羟基邻苯二甲酸酯脱羧酶 (K04102) 和1,4-二羟基-2-萘甲酰-CoA硫酯酶 (K12073) 的功能基因,其中的2个KO (KEGG Othology) (K04102和K12073) 被证实与HMW-PAHs和总PAHs质量分数呈正相关[43],这可能是HMW-PAHs去除率更高的原因,也说明低温ERH增强了PAHs污染土壤中相应生物降解途径。
温度从3个方面影响PAHs的降解。一,低温热处理引起土壤理化性质指标中的土壤pH降低,pH变化影响土壤中PAHs的化学行为和PAHs降解菌丰度,进而促进PAHs去除,研究证实低pH条件更利于土壤PAHs去除[50];二,低温热处理致使PAHs溶解度增加,其生物可利用性也随之增加,从而提高PAHs去除率;三,温度影响微生物活性和功能基因预测丰度,TAO等[51]研究显示,特定嗜热菌能在60 ℃温度下降解PAHs (尤其是HMW-PAHs),可能由于该菌产生的生物乳化剂在各种环境条件下均具有稳定的乳化活性,因此菌株在高温胁迫下的降解能力不受影响[52],本研究中80 ℃富集了厚壁菌门芽孢杆菌纲Geobacillus和Bacillus 2种PAHs降解菌属[40, 53],均属嗜热菌[54],抗逆性强,能在不利条件下存活[47],2种降解菌属经富集后,能更好地以多环芳烃为底物生长。低温热处理还增强了与HMW-PAHs降解有关功能基因的预测丰度,也可能导致PAHs降解率提高。
-
1)低温电阻加热处理可去除土壤PAHs,80 ℃加热180 min的条件下去除率为21.8%,其中4~5环PAHs去除率最高,低温热处理后PAHs降解菌丰度升高和HMW-PAHs降解相关的功能基因丰度升高可能是HMW-PAHs去除率高的原因。
2) 80 ℃加热180 min的条件下,电阻加热处理30%含水率和0.5%含盐率的土壤,会降低土壤pH,但不会对土壤肥力和养分水平造成负面影响。
3)低温电阻加热处理增加了土壤细菌丰度、群落丰富度、多样性和PAHs降解功能基因丰度,细菌丰度增幅高达108%;低温电阻加热处理还富集了PAHs降解菌,将厚壁菌门PAHs降解菌的相对丰度放大了近10倍,增幅主要由该门芽孢杆菌纲中的PAHs降解菌属Geobacillus和Bacillus贡献。
低温电阻加热对土壤多环芳烃去除和细菌群落的影响
Effects of low-temperature electrical resistance heating on soil polycyclic aromatic hydrocarbons removal and microorganisms
-
摘要: 针对电阻加热技术修复多环芳烃污染土壤存在能耗高、降低土壤功能性的问题,采用低温条件 (80 ℃) 的电阻加热以降低能耗、减少对土壤肥力和细菌群落的影响。利用自主研制的电阻加热装置,探究低温加热对土壤多环芳烃的去除效果、对土壤理化性质和细菌群落的影响。结果表明,在80 ℃加热180 min条件下,电阻加热对土壤多环芳烃的去除率为21.8%,苯并[a]蒽、苯并[b]荧蒽、苯并[k]荧蒽、䓛、二苯并[a,h]蒽、茚并[1,2,3-cd]芘和萘的质量分数均低于《土壤环境质量建设用地污染风险管控标准 (试行) 》 (GB 36600-2018) 第一类用地筛选值;电阻加热处理后细菌丰度增幅达108%,提高了群落丰富度和多样性,富集了多环芳烃降解菌和功能基因,将厚壁菌门PAHs降解菌的相对丰度放大了近10倍,提高了编码4,5-二羟基邻苯二甲酸酯脱羧酶 (K04102) 和1,4-二羟基-2-萘甲酰-CoA硫酯酶 (K12073) 的功能基因预测丰度,且不会对土壤肥力水平造成负面影响。本研究结果可为低温电阻加热在多环芳烃污染土壤修复中的应用提供参考。
-
关键词:
- 有机污染土壤 /
- 多环芳烃 /
- 低温电阻加热 /
- 细菌群落构成 /
- 多环芳烃降解功能基因
Abstract: To address the problems of high energy consumption and reduced soil functionality in the remediation of polycyclic aromatic hydrocarbons (PAHs) contaminated soil by electrical resistance heating (ERH), low-temperature (80 ℃) ERH was used to reduce energy consumption and impact on soil fertility and bacterial communities. The effect of low-temperature ERH on soil PAHs removal, soil physicochemical properties and bacterial community was investigated by using a self-made device. The results demonstrated that ERH treatment removed 21.8% of PAHs from soil, the contents of Benzo[a]anthracene, Benzo[b]fluoranthene, Benzo[k]fluoranthene, Chrysene, Dibenz[a,h]anthracene, Indeno[1,2,3-cd]pyrene and Naphthalene were all lower than the screening values for the first category of sites in the Soil Environmental Quality Construction Land Contamination Risk Control Standards (Trial) (GB36600-2018) after ERH treatment. ERH treatment increased bacterial abundance by 108%, improved community richness and diversity, and enriched PAHs-degrading bacteria and functional genes. ERH amplified the relative abundance of PAHs-degrading bacteria in Firmicutes phylum by nearly 10-fold and increased the predicted abundance of functional genes encoding 4,5-dihydroxyphthalate decarboxylase (K04102) and 1,4-dihydroxy-2-naphthoyl-CoA thioesterase (K12073) without negatively affecting soil fertility. The results can provide a reference for the remediation of PAHs-contaminated soil by low-temperature ERH treatment. -

-
图 1 电阻加热小试装置[12]
Figure 1. Schematic of the lab-scale ERH equipment
表 1 低温电阻加热加热处理前后土壤理化性质
Table 1. Basic physical and chemical characteristics of soil before and after ERH treatment
样品处理方式 pH 总碳/% 总氮/% 有机碳/% 全磷/% 全钾/% 电阻加热处理前 8.36±0.07 1.74±0.05 0.07±0.00 0.86±0.03 0.06±0.00 0.80±0.04 电阻加热处理后 8.11±0.09 1.80±0.15 0.08±0.00 1.00±0.04 0.06±0.00 0.86±0.04 注:不同处理间的显著性分析采用单因素ANOVA方差分析,表中指标各处理间均无显著性差异 (P > 0.05)。 表 2 低温电阻加热处理前后土壤细菌丰度和α多样性
Table 2. Diversity quantity of soil microorganisms after low-temperature ERH treatment
样品处理方式 细菌丰度/ (copies·g−1) α多样性指数 Chao1 Simpson Shannon Observed species 电阻加热处理前 0.12×108 5 333±1 300 1.00±0.00 10.5±1.0 4 967±1 210 电阻加热处理后 0.25×108 6 051±310 0.99±0.01 10.6±0.6 5 601±300 注:不同处理间的显著性分析采用单因素ANOVA方差分析,表中指标各处理间均无显著性差异 (P > 0.05)。 -
[1] 骆永明, 滕应. 我国土壤污染的区域差异与分区治理修复策略[J]. 中国科学院院刊, 2018, 33(2): 145-152. doi: 10.16418/j.issn.1000-3045.2018.02.003 [2] SAZYKIN I S, MINKINA T M, KHMELEVTSOVA L E, et al. Polycyclic aromatic hydrocarbons, antibiotic resistance genes, toxicity in the exposed to anthropogenic pressure soils of the Southern Russia[J]. Environmental Research, 2021, 194: 1-10. [3] 焦文涛, 韩自玉, 吕正勇, 等. 土壤电阻加热技术原位修复有机污染土壤的关键问题与展望[J]. 环境工程学报, 2019, 13(9): 2027-2036. doi: 10.12030/j.cjee.201905138 [4] 康绍果, 李书鹏, 范云. 污染地块原位加热处理技术研究现状与发展趋势[J]. 化工进展, 2017, 36(7): 2621-31. doi: 10.16085/j.issn.1000-6613.2016-2144 [5] HAN Z Y, JIAO W T, TIAN Y, et al. Lab-scale removal of PAHs in contaminated soil using electrical resistance heating: Removal efficiency and alteration of soil properties[J]. Chemosphere, 2020, 239: 1-8. [6] HORST J, MUNHOLLAND J, HEGELE P, et al. In situ thermal remediation for source areas: technology advances and a review of the market from 1988-2020[J]. Ground Water Monitoring and Remediation, 2021, 41(1): 17-31. doi: 10.1111/gwmr.12424 [7] MACBETH T W, TRUEX M J, POWELL T, et al. Combining low-energy Electrical Resistance Heating with biotic and abiotic reactions for treatment of chlorinated solvent DNAPL source areas[C]//U. S. Department of Defense. Applied Research Associates Inc. Albuquerque, 2012: 1-61. [8] 吴宜霖, 刘志号, 孙仲平, 等. 温度对土壤中多环芳烃缺氧微生物降解的影响[J]. 环境科学与技术, 2022, 45(5): 77-83. doi: 10.19672/j.cnki.1003-6504.2595.21.338 [9] FEITKENHAUER H, MARKL H. Biodegradation of aliphatic and aromatic hydrocarbons at high temperatures[J]. Water Science and Technology, 2003, 47(10): 123-130. doi: 10.2166/wst.2003.0555 [10] NAKASAKI K, SASAKI M, SHODA M, et al. Change in microbial numbers during thermophilic composting of sewage-sludge with reference to CO2 evolution rate[J]. Applied and Environmental Microbiology, 1985, 49(1): 37-41. doi: 10.1128/aem.49.1.37-41.1985 [11] VAN DER VOORT M, KEMPENAAR M, VAN DRIEL M, et al. Impact of soil heat on reassembly of bacterial communities in the rhizosphere microbiome and plant disease suppression[J]. Ecology Letters, 2016, 19(4): 375-382. doi: 10.1111/ele.12567 [12] 杨顺美, 焦文涛, 刘峰, 等. 电阻加热修复佳乐麝香污染土壤的工艺优化[J]. 环境工程学报, 2022, 16(4): 1284-1293. doi: 10.12030/j.cjee.202201004 [13] 田垚. 电阻加热耦合化学氧化对场地多环芳烃污染土壤的修复效果研究[D]. 太原: 山西大学, 2020. [14] 王瑞琨. 用电位法测定土壤pH值[J]. 山西化工, 2018, 38(3): 64-65. doi: 10.16525/j.cnki.cn14-1109/tq.2018.03.22 [15] 王亚婷. 元素分析仪同时测定土壤中的全氮和总碳[J]. 城市地质, 2022, 17(2): 249-254. doi: 10.3969/j.issn.1007-1903.2022.02.016 [16] 天津市环境监测中心, 辽宁省环境监测实验中心, 沈阳市环境监测中心站, 等. 土壤有机碳的测定重铬酸钾氧化-分光光度法: HJ 615-2011[S]. 北京: 中国环境科学出版社, 2011. [17] 韩海林, 蔡玮. 土壤全磷测试方法存在的问题及改进[J]. 浙江农业科学, 2017, 58(5): 877-878. doi: 10.16178/j.issn.0528-9017.20170548 [18] 王敏. 碱熔-火焰光度法测定土壤全钾应注意的问题[J]. 辽宁林业科技, 2016(6): 75-76. doi: 10.3969/j.issn.1001-1714.2016.06.026 [19] 王海棠, 于佩. 加速溶剂萃取-串联质谱法测定土壤中8种有机氯农药和16种多环芳烃[J]. 环境科技, 2017, 30(1): 63-66. doi: 10.3969/j.issn.1674-4829.2017.01.015 [20] WALKER N J. Real-time and quantitative PCR: Applications to mechanism-based toxicology[J]. Journal of Biochemical and Molecular Toxicology, 2001, 15(3): 121-127. doi: 10.1002/jbt.8 [21] BOLYEN E, RIDEOUT J R, DILLON M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J]. Nature Biotechnology, 2019, 37(9): 1091. [22] CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al. DADA2: High-resolution sample inference from Illumina amplicon data[J]. Nature Methods, 2016, 13(7): 581-583. doi: 10.1038/nmeth.3869 [23] KATOH K, MISAWA K, KUMA K, et al. MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform[J]. Nucleic Acids Research, 2002, 30(14): 3059-3066. doi: 10.1093/nar/gkf436 [24] ZHANG Y L, HAN Z G, WU H, et al. Rapid construction of maximum likelihood tree of HIV-1 pol gene by FastTree2.1. 8[J]. Chinese Journal of Aids & STD, 2017, 23(8): 695-699. [25] 中华人民共和国生态环境部, 中华人民共和国国家市场监督管理总局. 土壤环境质量标准-建设用地土壤污染风险管控标准: GB 36600-2018[S]. 北京: 中国环境出版集团, 2018. [26] 夏天翔, 姜林, 魏萌, 等. 焦化厂土壤中PAHs的热脱附行为及其对土壤性质的影响[J]. 化工学报, 2014, 65(4): 1470-1480. doi: 10.3969/j.issn.0438-1157.2014.04.043 [27] FALCIGLIA P P, DE GUIDI G, CATALFO A, et al. Remediation of soils contaminated with PAHs and nitro-PAHs using microwave irradiation[J]. Chemical Engineering Journal, 2016, 296: 162-172. doi: 10.1016/j.cej.2016.03.099 [28] ZHANG X X, WANG X M, LI C, et al. Ligninolytic enzyme involved in removal of high molecular weight polycyclic aromatic hydrocarbons by Fusarium strain ZH-H2[J]. Environmental Science and Pollution Research, 2020, 27(34): 42969-42978. doi: 10.1007/s11356-020-10192-6 [29] 胡艳军, 余帆, 陈江, 等. 污泥热解过程中多环芳烃排放规律[J]. 化工学报, 2018, 69(8): 3662-3669. [30] YI Y M, PARK S, MUNSTER C, et al. Changes in ecological properties of petroleum oil-contaminated soil after low-temperature thermal desorption treatment[J]. Water, Air and Soil Pollution, 2016, 227(4): 108. doi: 10.1007/s11270-016-2804-4 [31] 杨帆, 徐洋, 崔勇, 等. 近30年中国农田耕层土壤有机质含量变化[J]. 土壤学报, 2017, 54(5): 1047-1056. [32] 朱寒阳, 傅海平, 张国林, 等. 不同施肥措施对茶园土壤酶活性及土壤肥力的影响[J]. 江苏农业科学, 2018, 46(23): 371-374. doi: 10.15889/j.issn.1002-1302.2018.23.091 [33] BARCENAS-MORENO G, ROUSK J, BAATH E. Fungal and bacterial recolonisation of acid and alkaline forest soils following artificial heat treatments[J]. Soil Biology and Biochemistry, 2011, 43(5): 1023-1033. doi: 10.1016/j.soilbio.2011.01.019 [34] 成浩. 交流电场与Fusarium sp. A-2真菌耦合对博落回修复铀污染土壤的强化作用[D]. 衡阳: 南华大学, 2021. [35] 汪殿蓓, 暨淑仪, 陈飞鹏. 植物群落物种多样性研究综述[J]. 生态学杂志, 2001(4): 55-60. doi: 10.3321/j.issn:1000-4890.2001.04.015 [36] DONG F, YAN Q Y, LI X, et al. Study on bacterial community structure in greenhouse vegetable soils affected by soil temperature and fertilization pattern using T-RFLP technology[J]. Soils, 2019, 51(3): 495-501. [37] WIPF H M L, THAO-NGUYEN B, COLEMAN-DERR D. Distinguishing between the impacts of heat and drought stress on the root microbiome of sorghum bicolor[J]. Phytobiomes Journal, 2021, 5(2): 166-176. doi: 10.1094/PBIOMES-07-20-0052-R [38] SUN Z P, WANG L, YANG S C, et al. Thermally enhanced anoxic biodegradation of polycyclic aromatic hydrocarbons (PAHs) in a highly contaminated aged soil[J]. Journal of Environmental Chemical Engineering, 2022, 10(2): 107236. doi: 10.1016/j.jece.2022.107236 [39] 任久生. 增温对大兴安岭多年冻土区泥炭地土壤微生物的影响研究[D]. 长春: 中国科学院大学(中国科学院东北地理与农业生态研究所), 2018. [40] UBANI O, ATAGANA H I, SELVARAJAN R, et al. Unravelling the genetic and functional diversity of dominant bacterial communities involved in manure co-composting bioremediation of complex crude oil waste sludge[J]. Heliyon, 2022, 8(2): 1-15. [41] LV L H, SUN L A, YUAN C L, et al. The combined enhancement of RL, nZVI and AQDS on the microbial anaerobic-aerobic degradation of PAHs in soil[J]. Chemosphere, 2022, 307(1): 135609. [42] MANDREE P, MASIKA W, NAICKER J, et al. Bioremediation of polycyclic aromatic hydrocarbons from industry contaminated soil using indigenous Bacillus spp[J]. Processes, 2021, 9(9): 1606. doi: 10.3390/pr9091606 [43] ZHAO Y Y, DUAN FA, CUI Z J, et al. Insights into the vertical distribution of the microbiota in steel plant soils with potentially toxic elements and PAHs contamination after 60 years operation: Abundance, structure, co-occurrence network and functionality[J]. Science of the Total Environment, 2021, 786: 147338. doi: 10.1016/j.scitotenv.2021.147338 [44] 王乔, 郑瑞, 孙学婷, 等. 睾丸酮丛毛单胞菌对羊草根际土壤PAHs降解及细菌群落结构的影响[J]. 生物工程学报, 2020, 36(12): 2657-2673. doi: 10.13345/j.cjb.200381 [45] LIN W J, GUO C L, ZHANG H, et al. Electrokinetic-enhanced remediation of phenanthrene-contaminated soil combined with Sphingomonas sp GY2B and biosurfactant[J]. Applied Biochemistry and Biotechnology, 2016, 178(7): 1325-1338. doi: 10.1007/s12010-015-1949-8 [46] 李凤梅, 郭书海, 张灿灿, 等. 多环芳烃降解菌的筛选及其在焦化场地污染土壤修复中的应用[J]. 环境污染与防治, 2016, 38(4): 1-5. doi: 10.15985/j.cnki.1001-3865.2016.04.001 [47] 尹丽娟. 芽孢杆菌(bacillus)Y2菌株与菲(phenanthrene)的相互作用研究 [D]. 昆明: 云南大学, 2016. [48] 宋宇, 王健, 苏振成, 等. PAHs污染土壤的物理强化修复过程中土壤细菌的响应[J]. 生态学杂志, 2016, 35(6): 1547-1552. doi: 10.13292/j.1000-4890.201606.024 [49] XU H, TONG N, HUANG S B, et al. Degradation of 2, 4, 6-trichlorophenol and determination of bacterial community structure by micro-electrical stimulation with or without external organic carbon source[J]. Bioresource Technology, 2018, 263: 266-272. doi: 10.1016/j.biortech.2018.05.015 [50] 付登强, 滕应, 骆永明, 等. 土壤pH、水分及温度对长期污染土壤中苯并(a)芘动态变化的影响初探[J]. 土壤, 2012, 44(3): 444-449. doi: 10.3969/j.issn.0253-9829.2012.03.014 [51] TAO W Y, LIN J Z, WANG W D, et al. Biodegradation of aliphatic and polycyclic aromatic hydrocarbons by the thermophilic bioemulsifier-producing Aeribacillus pallidus strain SL-1[J]. Ecotoxicology and Environmental Safety, 2020, 189: 109994. doi: 10.1016/j.ecoenv.2019.109994 [52] 吴洁婷, 许琪, 张营, 等. 微生物降解典型高分子量多环芳烃的研究进展[J]. 环境科学研究, 2021, 34(8): 1981-1990. doi: 10.13198/j.issn.1001-6929.2021.05.14 [53] YU C, YAO J, CAI M M, et al. Polycyclic aromatic hydrocarbons degrading microflora in a tropical oil-production well[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 93(5): 632-636. doi: 10.1007/s00128-014-1371-x [54] DEREKOVA A, MANDEVA R, KAMBOUROVA M. Phylogenetic diversity of thermophilic carbohydrate degrading bacilli from Bulgarian hot springs[J]. World Journal of Microbiology and Biotechnology, 2008, 24(9): 1697-1702. doi: 10.1007/s11274-008-9663-0 -




 下载:
下载: