-
颗粒有机质 (particulate organic matter,POM) 是指水体颗粒物的有机组分,其可吸附水中的C[1]、N[2]、P[3]、重金属[4]、Norfloxacin[5]等物质。POM是水体颗粒物的重要组成部分,对水中污染物的迁移及转化起重要作用。颗粒有机质常包括藻类[6]、细菌[7]、浮游生物[8]、有机碎屑[9-10]等多种组分。由于其成分多样、来源复杂,且收集及分离提取都较为困难,故对其组分结构及来源研究相对较少。常用于颗粒有机质组分分析及溯源分析的方法有光谱法[11]、质谱法[12]、色谱法[13]、波谱法[14]、同位素法[15]。同位素法是针对自然环境中不同物质的同位素组成不同 (例如部分陆生植物中的碳同位素受光合作用的比率会发生变化) ,通过追踪物质中的稳定同位素来辨析其来源的一种方法,在物源示踪方面应用较为广泛[16-18]。利用同位素法对物质进行溯源常依托于溯源模型,其中稳定同位素混合模型被认为是一种高效、准确的溯源模型[19-20]。
随着计算机科学领域的快速发展,稳定同位素溯源模型不断迭代更新,相关学者相继提出了线性模型[21]、质量守恒模型[22]、IsoSource模型[23]、MixSIR模型[24]、SIAR模型[25]、Simmr[26]、MixSIAR模型[27]等。贝叶斯模型 (Bayesian mixing models) 是近年来提出的一种基于质量守恒和贝叶斯框架的混合模型,相较于其他模型,其优势在于可将固定和随机效应作为协变量来解释混合比例的可变性同时加入马尔可夫链蒙特卡 (Markov Chain Monte Carlo,MCMC) 方法解决后验分布问题,从而极大提高了模型溯源分析的准确性和可信性[24]。MixSIAR是贝叶斯模型中目前最新提出的溯源模型之一,其整合了MOORE在2008年提出的MixSIR模型和Parnell在2010年提出的SIAR模型,已被国外学者广泛使用[24-25]。近年来,众多学者已成功运用碳、氮稳定同位素技术结合模型对鄱阳湖[28]、密云水库[29]、三峡水库[30]、洱海[31]等国内水体进行了碳、氮稳定同位素特征变化研究和有机质的来源解析。然而,这些研究多集中于沉积物中有机质的溯源,对颗粒有机质的溯源研究还较少。
白洋淀是我国北方大型的草型浅水湖泊,拥有9条呈树状分布的入淀河流。其中,府河、白沟引河、孝义河3条河流常年有水,淀内水动力受不同入淀河流影响波动较大[32]。淀中沟壕交错纵横,大量芦苇台田将淀内的敞水水域分割开来,下垫面类型复杂,构成了淀中复杂的生境系统[33]。淀内水生植物丰富,芦苇、菹草、睡莲等水生植物均属优势物种。这些植物在腐解过程中产生的有机碎屑悬浮于水中,并会释放出C、N、P等营养盐造成水质恶化[34-35]。受入淀河流输入和内源污染的双重影响,淀内颗粒有机质成分较为多样且来源复杂,易向水中释放出C、N、P等营养物质,造成白洋淀水质变差。因此,明晰白洋淀内颗粒有机质的来源,对淀区水环境保护意义重大,但目前其来源尚不确定,迫切需要对其中的颗粒有机质溯源开展研究。
为明确白洋淀颗粒有机质碳氮同位素特征及来源,以白洋淀悬浮颗粒物为研究对象,采用稳定同位素技术结合MixSIAR贝叶斯混合模型,通过δ13C、δ15N和C/N确定颗粒有机质来源范围,分析白洋淀颗粒有机碳、氮同位素的特征,并运用模型量化淀内颗粒有机质不同来源的贡献率及各端元的贡献率差异,结合环境因子等信息详尽的解释白洋淀颗粒有机质的来源特征,以期为白洋淀水环境与水生态治理保护提供参考。
-
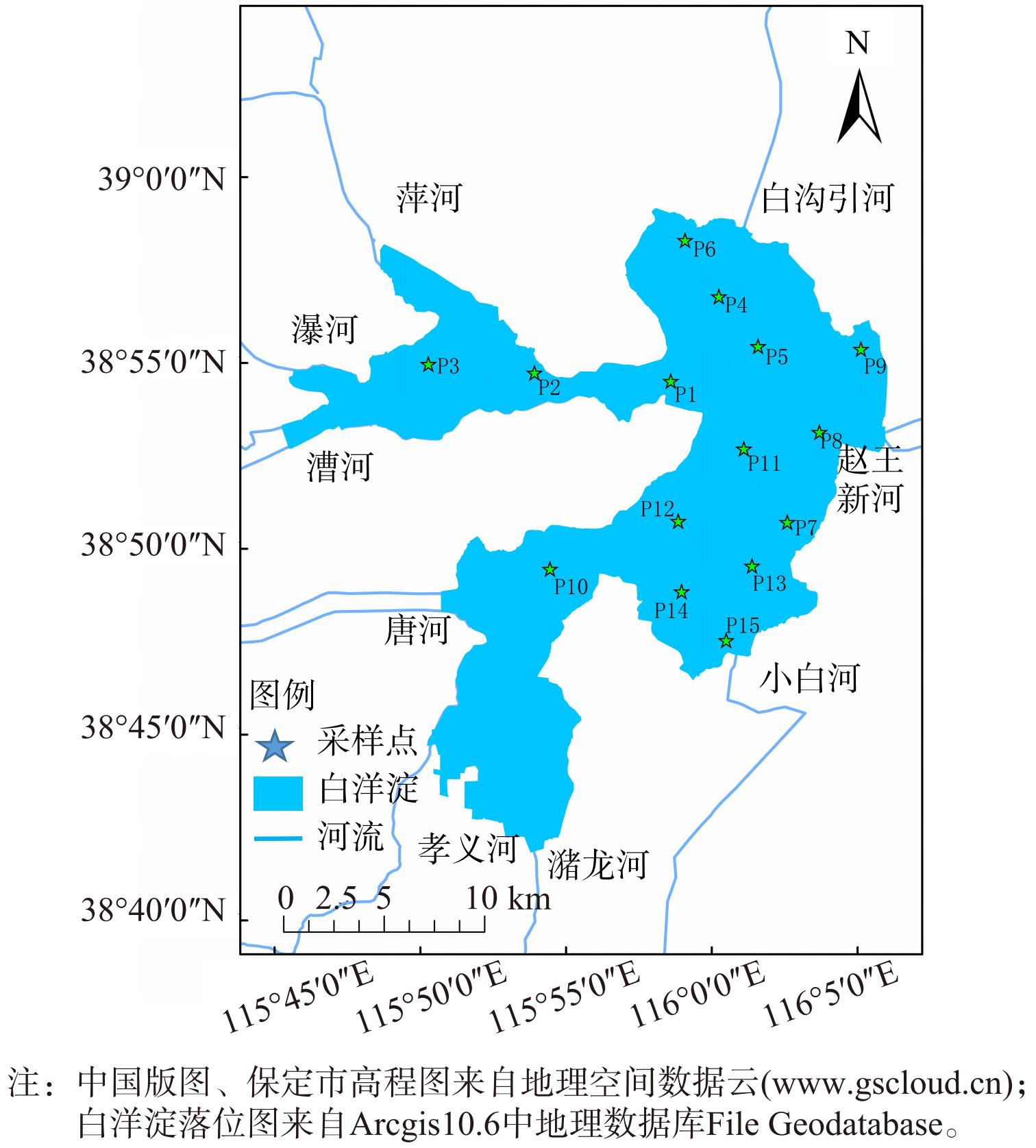
白洋淀位于河北省雄安新区境内(东经 115°39'~116°11',北纬 38°48'~38°57'),是华北地区大型的内陆湖泊湿地,属于海河流域大清河水系。全淀区共由99个百亩以上淀泊和上万条大小沟壕交错构成,水域总面积366.4 km2,人口稠密,分布有圏头、采蒲台、大田庄等40个淀中村[36]。淀区属温带大陆季风气候,年平均气温7 ℃,降水多集中在6-9月(70%),年平均降水量为582 mm[37]。相较于其他季节,夏季是白洋淀全年中水质及生态水文过程最为活跃与复杂的时期,同时也是整个白洋淀流域与淀区物质能量交换最为密切的时期,是最具代表性的季节。
-
采样工作于2022年8月进行,采样点位覆盖全淀区,共采集上覆水样品15个,采样点分布如图1所示。样品采集选用2.5 L有机玻璃采水器(WB-PM-2.5 L,普雷德,中国)采集上覆水60 L于干净塑料桶内,运回野外实验站后迅速用Whatman GF/F玻璃纤维滤膜(450 ℃,灼烧3 h)进行过滤,收集悬浮颗粒物,将带有悬浮颗粒物的滤膜于−50 ℃真空冷冻干燥,并置于样品袋中保存备用[38]。
水样温度(T)、pH、氧化还原电位(ORP)采用水质分析仪(Professional Plus,YSI,USA)分析,溶解氧(DO)使用便携式溶解氧测定仪(HQ30d,HACH,USA)测定。上覆水经过0.45 µm滤膜的水样用于溶解性有机氮 (DON) 、溶解性有机碳 (DOC) 、NH4+-N、NO3−-N浓度的测定。其中,溶解性有机氮 (DON) 质量浓度采用差减法,即ρ (DON) =ρ (TDN) -ρ (NH4+-N) -ρ (NO3−-N) ,ρ (NO2−-N) 过低,此处忽略不计;叶绿素a (Chla) 测定方法为丙酮提取法[38]。
悬浮颗粒物有机质 (POM) 浓度含量测定采用烧矢量法,将0.45 µm滤膜放于马弗炉内在450 ℃烘1 h后取出在干燥器内冷却至室温 (0.5~1 h) 称重,取500 mL上覆水过滤,将滤后的滤膜再次放入马弗炉内在450 ℃烘1 h后取出在干燥器内冷却至室温 (0.5~1 h) 称重,滤膜前后质量差除以过滤水样体积及为POM浓度。颗粒有机碳 (POC) 、颗粒有机氮 (PON) 用元素分析仪(Vario MACRO cube,Elementar)测定,颗粒有机碳、氮同位素 (δ13C、δ15N) 用同位素质谱仪((Thermo Fisher Scientific Inc,USA)测定[39]。
-
研磨过筛后的悬浮颗粒物样品,加入0.5 mol/L HCl酸化以去除无机碳酸盐,再用去离子水淋洗样品直至滤液呈中性,并用硝酸银溶液来检测样品中有无Cl−残留,然后将去除无机碳的样品进行冷冻干燥。经过上述处理后的样品在中国科学院生态环境研究中心水质学国家重点实验室用元素分析仪(Vario MACRO cube,Elementar)和同位素质谱仪(Thermo Fisher Scientific Inc,USA)联用测定有机碳、氮的含量及稳定同位素组成,计算公式见式 (1) 和 (2) 。
式中:Rsample为待测样品同位素比值;Rstandard为标准参比样品同位素比值;13C/12C 和15N/14N分别对应于国际标准Vienna PDB与大气中的氮标准,分析误差为<±0.2‰。样品的C/N比值可由测定的颗粒有机碳含量与颗粒有机氮含量计算得到[19]。
依据计算得到的稳定同位素值,可将颗粒有机碳、氮来源分为以下几种:颗粒有机碳主要包含陆生植物 (−23‰~−30‰) 、土壤有机质 (−26‰~−21‰) 、水生植物 (−30‰~−16‰) 、浮游植物和藻类 (−42‰~−24‰) 等[40-42]。颗粒有机氮来源主要包含土壤流失氮 (−10‰~15‰) 、土壤有机质 (0‰~5‰) 、工业及生活污水 (11‰~24‰) 、人造氮肥 (−3‰~3‰) 、水生植物 (−10‰~20‰) 、浮游植物 (−15‰~20‰) 、陆生植物 (3‰~7‰) 等[43-44]。
-
MixSIAR贝叶斯混合模型是指用来估计不同来源对混合物贡献的模型,可以表示为式 (3) 和 (4) 。
式中:Xij为混合物的i同位素值j, (i=1,2,3,…,N;j = 1,2,3,…,J) ;Sjk为源K中同位素j (k=1,2,3,…,K) ,正态分布,均值µkj ,标准差 ɷ2jk;pk为源k占比,由模型估算Cjk 为源k中j同位素的分馏因子,均值λj k ,标准差
$ \tau $ 2jk正态分布;$ \epsilon $ jk为残余误差,表示各组分间的附加未量化变异,其均值为O,标准差为σ2jk[16]。MixSIAR模型以颗粒有机质各端元的δ13C、δ15N作为输入参数来计算各端元具体贡献率,该方法在R语言 (The R Programming Language,版本4.1.3) 的条件下,RStudio (2022) 中编写并运行完成[45] 。
-
原始数据的统计处理选用Excel (2010);文章内的图表进行绘制由Origin 9.0完成;采样点的分布及插值图的绘制由ArcMap(10.2)完成;贡献率的定量分析通过R studio (4.1.3) 、RStudio (2022) 及JAGS (4.3.0) 计算完成。
-
上覆水中DOC等基本理化指标分布特征见表1。上覆水温度 (T) 为26.20~31.60 ℃,均值为 (28.40±1.91) ℃,总体分布无太大差异。DOC质量浓度为2.62~6.40 mg·L−1,均值为 (4.87±0.91) ,全淀区浓度差异较小,最高值出现在P6号采样点。DON质量浓度与DOC质量浓度分布情况相似,为0.16~0.47 mg·L−1,均值为 (0.37±0.10) mg·L−1,最低值均出现在P3号采样点。Chla质量浓度分布差异较大,为9.31~69.05 µg·L−1,均值为 (28.35±17.48) µg·L−1,最高值69.05 µg·L−1出现于淀区水域西北部。POM质量浓度分布与Chla较为相似,为9.31~69.05 µg·L−1,均值为 (5.55±2.90) mg·L−1,高值点同样出现于淀区的西北部。
-
白洋淀颗粒有机质碳氮含量整体空间分布存在较大差异 (图2) 。全淀区POC含量为35.46~219.14 g·kg−1,均值为86.02 g·kg−1,其中最高值出现于P5号点位。此点位位于淀区北部白沟引何来水与西部府河来水的交汇处。两条入淀河流携带的颗粒有机质汇集于此,可能是导致该点位颗粒有机质明显高于其他点位的原因[46-47]。PON含量为4.44~29.32 g·kg−1,均值为11.37 g·kg−1。整体分布特征与POC一致,最高值同样出现于P5号点位。这表明POC与PON具有一定的同源性。该分布特征与2.1中所提到的DOC及DON的质量浓度分布特征相似。白洋淀溶解性有机碳来自于淀内水生植物腐解所产生的副产物,推测颗粒有机碳与水生植物腐解过程中产生的副产物有关[34]。
-
白洋淀颗粒有机质δ13C、δ15N同位素及C/N整体变化较小。由图2可知,白洋淀δ13C稳定同位素值为−32.95‰~−25.27‰,δ15N稳定同位素值为3.86‰~7.08‰,C/N为6.91~8.31。与地理位置和气候条件相似的密云水库相比较发现,夏季密云水库中的颗粒有机质δ13C、δ15N分别为−30.70‰~−29.20‰和3.42‰~4.11‰,实测值均接近夏季白洋淀颗粒有机质且变化范围小于白洋淀。这表明二者颗粒有机质的来源具有一定相似性[29]。相关学者对密云水库夏季颗粒有机质的来源计算结果表明,密云水库中的颗粒有机质主要以内源自生为主,由此推测夏季白洋淀的颗粒有机质同样以内源自生为主。但白洋淀颗粒有机质的δ13C、δ15N变化范围高于密云水库 (δ13C为−32.95‰~−25.27‰>−30.70‰~−29.20‰、δ15N为3.86‰~7.08‰>3.42‰~4.11‰) 。这表明相较于密云水库,白洋淀的颗粒有机质来源较多且相对更为分散,且受到其他潜在来源的影响[29]。
白洋淀悬浮颗粒物δ13C、δ15N同位素整体空间分布存在差异,稳定同位素值变化范围由淀南向淀北逐渐偏正 (图3) 。从全淀空间分布的角度看,白洋淀悬浮颗粒物δ13C、δ15N高值均出现于淀区西北角和淀区北部。结合其他研究对有机质δ13C、δ15N溯源分析结,推测淀区中部及南部的颗粒有机质来源多以水中的浮游植物为主[48]。分析其原因可能是浮游植物的端元值 (−30‰和5‰) 更为接近南部颗粒有机质δ13C、δ15N实测值 (−30.79‰和4.91‰) ,自南向北颗粒有机质δ13C、δ15N实测值逐渐向水生植物端元值 (−28.6‰) 靠近。这表明由浮游植物端元贡献的颗粒有机质逐渐减少,转变为水生植物端元贡献逐渐增多。这一结论也与白洋淀的实际状况相符,淀区北部及西北部存在大量水生植物,而淀南和淀中则多以村落临近水域为主,水生植物覆盖率较低。同时,淀中村频繁的人为活动产生的N、P污染物进一步促进了浮游植物的生长繁殖,导致淀南的浮游植物丰度高于淀北,其对颗粒有机质的来源贡献相应增加[49]。
白洋淀悬浮颗粒物以内源自生为主,由北向南自生源贡献逐渐增加。根据图2碳氮同位素分布特征可知,δ13C主要贡献端元为水生植物 (−30‰~−16‰,端元值−28.6‰) 和浮游植物 (−42‰~−24‰,端元值−30‰) ,实测值与端元值均较为接近。白洋淀北部相较于南部沼泽化程度较高,分布大量荷花和芦苇等水生植物[50]。由于淀南及淀中村落较多,南部采样点多分布于淀中村附近,周围相对于淀区北部的水生植物密度较低。该因素增加了浮游植物对颗粒有机质的贡献。当浮游植物贡献率高时,颗粒有机质δ13C、δ15N会更加偏负。这一结论也与图3中的δ13C、δ15N分布特征相一致。
-
通过以上对δ13C、δ15N特征及分布的讨论,初步明确了白洋淀悬浮颗粒有机质的来源以内源自生为主,且主要来源为水生植物和浮游植物,但并未明确内、外潜在来源及贡献程度。因此,需结合δ13C、δ15N及C/N对白洋淀水体悬浮颗粒有机质的潜在来源深入分析,运用MixSIAR模型对白洋淀悬浮颗粒有机质定量溯源[27]。
-
根据白洋淀悬浮颗粒物δ13C、δ15N及C/N的实测值,可判断白洋淀颗粒有机碳来源可能包括陆生植物、土壤有机质、水生植物、浮游植物。颗粒有机氮来源可能包括土壤流失氮、土壤有机质、水生植物、浮游植物、陆生植物。结合白洋淀的实际情况,最终确定了包括土壤有机质、浮游植物、陆源植物、水生植物在内的4个重要端元,各端元分布如图4所示。然而,这一结果仅定性确定了各重要端元的数量,并未定量确定淀中的颗粒有机质的来源状况,且其他潜在端元贡献的贡献率占比大小。因此,需要进一步定量化地描述各端元对白洋淀颗粒有机质的贡献。
-
通过模型对全淀区的颗粒有机质δ13C、δ15N分别计算出端元贡献率:δ13C对颗粒有机碳的溯源结果为浮游植物 (42.20%) >水生植物 (29.40%) >陆源植物 (17.60%) >土壤有机质 (10.80%) ;δ 15N对颗粒有机氮的溯源结果为陆源植物 (31.90%) >浮游植物 (31.70%) >水生植物 (30.80%) >土壤有机质 (5.60%) 。δ 13C计算结果表明浮游植物对颗粒物中的有机碳贡献率 (41.20%) 高于通过δ15N计算结果 (31.70%) 。这说明水环境中浮游植物对颗粒有机碳、氮的来源贡献率存在差异。蓝藻、绿藻和硅藻是白洋淀内浮游植物的优势物种[51],在夏季水温达到浮游植物生长的最适温度,同时硅藻等藻类也达到一年中的生长爆发期。浮游植物的大量繁殖和适宜的水温进一步导致内源细菌对浮游植物降解速率的加快,还未完全被微生物降解的植物碎屑大量悬浮在水中形成颗粒有机质且这些碎屑的有机碳含量极高[52-53]。因此,从夏季白洋淀中微生物的内源降解角度分析,单以δ13C同位素计算悬浮颗粒有机质的来源,会导致浮游植物对颗粒有机质的计算结果偏高。
白洋淀中的颗粒有机质来源差异性较小、同位素信号较为集中,仅靠δ13C或δ15N单种同位素的计算结果仅代表该种稳定同位素的来源特征,并不能真实反映颗粒有机质的整体来源,而将δ13C、δ15N和C/N相结合分析会更加科学、准确[54]。因此,本研究将通过δ13C、δ15N两种稳定同位素相结合的方法综合计算颗粒有机质不同端元的贡献率[55]。将不同端元的δ13C、δ15N作为参数,输入值为平均值和标准差,代入模型中得到结果如图5所示。结果表明,夏季白洋淀颗粒有机质主要来自于浮游植物 (28.60%~37.40%) 和水生植物 (30.20%~31.30%) ,其次是陆源植物 (22.40%~34.30%) 和土壤有机质 (5.80%~10.70%) 。这表明白洋淀的颗粒有机质以内源自生为主的,总占比为59.90%;外源输入其次,总占比为40.10%。
水生植物、浮游植物和陆源植物是白洋淀悬浮颗粒有机质的主要来源。3个主要端元占比总和达90%以上。白洋淀中的水生植物覆盖度高达30%~40%,包括挺水植物 (芦苇和莲为主) 、沉水植物 (菹草和金鱼藻为主) 、浮叶植物 (睡莲为主) 和漂浮植物 (浮萍为主) ,且水生植物的优势类群受季节变化的影响[56]。相关学者对夏季白洋淀中的芦苇、菹草和浮萍三类优势物种的腐解过程进行了研究,发现水生植物的残体及其腐解过程中产生的悬浮碎屑中含有大量有机碳氮。这些植物碎屑将水中的微生物吸附在其表面并发生化学反应,释放出大量的有机组分及C、N、P等无机营养盐[57-58]。经水生植物腐解产生的植物碎屑等有机组分通过分子间的范德华力逐渐聚集在一起,形成了较大的有机团聚体。这些团聚体吸附在水体中无机矿物的表面,使其体积增大、密度减小、更易于悬浮在水中,最终成为白洋淀悬浮颗粒有机质的重要来源[59-62]。
基于上述分析,夏季白洋淀POM来源丰富,以内源自生为主 (59.9%) ,浮游植物和水生植物是其主要来源。结合目前白洋淀的现状,建议加大对内源的调节和管控,在适当的时节收割淀内芦苇等挺水植物;在夏末秋初时节适当的对沉水植物及藻类残体进行打捞,避免因季节交替导致水生植物和浮游植物大量腐解,造成悬浮颗粒有机质含量上升,带来水环境恶化的风险。实现这种调控能极大地降低自生源对颗粒有机质的贡献,进而切断颗粒有机质对于水环境中有机碳氮的贡献,确保水质的达标和稳固提升。
-
1) 白洋淀悬浮颗粒有机碳氮含量分布特征相似,空间上整体分布差异较大;颗粒有机质δ13C、δ15N同位素及C/N整体变化较小,δ13C、δ15N整体水平偏低,稳定同位素值变化范围由淀南向淀北逐渐偏正,推测由淀南向淀北颗粒有机质的自生源贡献度逐渐降低。
2) 白洋淀悬浮颗粒有机质以内源自生 (59.9%) 为主,其次为外源输入 (40.1%) ,颗粒有机质主要来自于浮游植物 (28.6%~37.4%) 和水生植物 (30.2%~31.3%) ,其次是陆源植物 (22.4%~34.3%) 和土壤有机质 (5.8%~10.7%) 。
3) 白洋淀悬浮颗粒有机质以浮游植物和水生植物来源的内源自生为主,因此对内源的调节和管控可有效的降低自生源对颗粒有机质的贡献,进一步切断其对水环境中的有机碳氮的贡献,对白洋淀的水环境保护及水质提升具有重要意义。
夏季白洋淀颗粒的有机质碳氮同位素特征及其来源解析
Carbon and nitrogen isotope characteristics and source analysis of particulate organic matter in Baiyangdian in summer
-
摘要: 为阐明白洋淀颗粒有机质碳氮同位素空间分布差异及其来源,于2022年9月测定了白洋淀夏季悬浮颗粒物样品中颗粒有机碳 (POC) 、颗粒有机氮 (PON) 、δ13C和δ15N,并运用MixSIAR模型对颗粒有机质来源进行分析。结果表明,白洋淀内POC和PON质量分数分别为3.55%~21.91%和0.44%~2.93%,全淀区POC和PON整体水平处于8.60%±5.52%和1.14%±0.72%,受入淀河流的影响,POC、PON整体空间分布存在较大差异;δ13C和δ15N的范围分别为−25.27‰~−32.95‰和3.86‰~7.32‰,呈由淀南向淀北逐渐偏正的趋势,表明由南向北外源贡献升高,自生源贡献降低。贝叶斯混合模型计算结果表明,悬浮颗粒有机质主要来源于浮游植物 (28.60%~37.40%) 、陆源植物 (22.40%~34.30%) 和水生植物 (30.20%~31.30%) ,内源自生贡献率高达59.90%。基于上述研究,提出在适当的时期通过收割淀内芦苇等挺水植物及适当的对沉水植物及藻类残体进行打捞的工程措施,可有效降低自生源对于有机质的贡献,进而切断有机质对于水环境中有机碳氮的贡献,确保水质的达标和稳固提升。本研究结果可为白洋淀的水质保护及修复提供理论参考。Abstract: In order to clarify the spatial distribution difference and source of carbon and nitrogen isotope of particulate organic matter in Baiyangdian, particulate organic carbon (POC), particulate organic nitrogen (PON), δ13C and δ15N in suspended particulate matter samples of Baiyangdian in summer were measured in September 2022, and the source of particulate organic matter was analyzed by MixSIAR model. The results showed that the concentrations of POC and PON in Baiyang Lake were 3.55% to 21.91% and 0.44% to 2.93%, respectively. The overall levels of POC and PON in the whole lake area were 8.60% ± 5.52% and 1.14% ± 0.72%, affected by the rivers flowing into the lake, the overall spatial distribution of POC and PON was quite different. The range of δ13C and δ15N were -25.27‰ to -32.95‰ and 3.86 ‰ to 7.32‰, respectively. The δ13C and δ15N showed a gradually positive trend from south to north, indicating that the contribution of exogenous sources increased from south to north, and the contribution of endogenous sources decreased. The results of Bayesian mixed model calculation showed that suspended particulate organic matter was mainly derived from phytoplankton ( 28.60 % to 37.40 % ), terrestrial plants ( 22.40 % to 34.30 % ) and aquatic plants ( 30.20 % to 31.30 % ), and the endogenous contribution rate was as high as 59.90 %. Based on the above research, it was proposed that the contribution of endogenous sources to organic matter could be effectively reduced by harvesting emergent plants such as reeds in the lake and appropriate engineering measures for salvaging submerged plants and algae residues at an appropriate time, thus cutting off the contribution of organic matter to organic carbon and nitrogen in the water environment and ensuring the compliance and stable improvement of water quality.The results of this study can provide a theoretical reference for water quality protection and restoration of Baiyangdian Lake.
-

-
表 1 白洋淀上覆水基本理化性质
Table 1. Physical-chemical properties of surface water in Baiyangdian Lake
采样
点位DOC/
(mg·L−1)DON/
(mg·L−1)Chla/
(µg·L−1)POM/
(mg·L−1)T/
℃P1 4.73 0.36 36.35 4.60 27.20 P2 4.92 0.33 48.44 11.80 27.40 P3 4.33 0.16 9.59 1.20 26.20 P4 3.52 0.33 10.96 6.00 26.50 P5 4.52 0.33 9.31 6.80 29.00 P6 2.62 0.17 11.26 2.50 26.00 P7 6.4 0.44 33.7 7.90 28.40 P8 5.7 0.47 26.79 3.00 29.10 P9 5.53 0.38 31.84 7.80 25.30 P10 5.72 0.46 69.05 9.70 29.50 P11 5.35 0.38 18.51 5.60 28.30 P12 4.63 0.47 24.77 6.40 30.50 P13 4.67 0.47 53.79 4.90 31.60 P14 4.83 0.37 31.13 2.20 31.00 P15 5.54 0.42 9.84 2.80 30.70 -
[1] LEE H, HUR J, SHIN H. Photochemical and microbial transformation of particulate organic matter depending on its source and size, Science of The Total Environment, 2022, 857(2): 159506. [2] FANG T H, WANG C W. Dissolved and particulate phosphorus species partitioning and distribution in the Danshuei River Estuary, Northern Taiwan[J]. Marine Pollution Bulletin, 2019, 151. [3] LI X, ZHOU Y, LIU G, et al. Mechanisms of the photochemical release of phosphate from resuspended sediments under solar irradiation[J]. Science of the Total Environment, 2017, 595: 779-786. doi: 10.1016/j.scitotenv.2017.04.039 [4] TAN M, LIU S, CHEN N, et al. Hydroxyl radicals induced mineralization of organic carbon during oxygenation of ferrous mineral-organic matter associations: Adsorption versus coprecipitation[J]. Science of the Total Environment, 2022, 816. [5] WANG Y, YU W, CHANG Z, et al. Effects of dissolved organic matter on the adsorption of norfloxacin on a sandy soil (fraction) from the Yellow River of Northern China[J]. Science of the Total Environment, 2022, 848(2): 157495. [6] MIN G, SIMONEIT B, GANTAR M, et al. Occurrence and distribution of novel botryococcene hydrocarbons in freshwater wetlands of the Florida Everglades[J]. Chemosphere, 2008, 70(2): 224-236. [7] AMON R M W, BEENER R. Bacterial utilization of different size classes of dissolved organic matter[J]. Limnology and Oceanography, 1996, 41(1): 41-51. doi: 10.4319/lo.1996.41.1.0041 [8] ROMER-CASTILLO C, SARMENTO H, ALBAREZ-SALGADO, et al. Production of chromophoric dissolved organic matter by marine phytoplankton[J]. Limnology & Oceanography, 2010, 55(3): 446-454. [9] MOORE J C, BERLOW E L, COLEMAN D C, et al. Detritus, trophic dynamics and biodiversity[J]. Ecology Letters, 2010, 7(7): 584-600. [10] PISANI O, YAMASHITA Y, JAFFE R. Photo-dissolution of flocculent, detrital material in aquatic environments: Contributions to the dissolved organic matter pool[J]. Water Research, 2011, 45(13): 3836-3844. doi: 10.1016/j.watres.2011.04.035 [11] HU B, WANG P, WANG C, et al. Photogeochemistry of particulate organic matter in aquatic systems: A review[J]. Science of The Total Environment, 2022, 806: 150467. doi: 10.1016/j.scitotenv.2021.150467 [12] LEENHEER J A, CROUE J P. Peer Reviewed: Characterizing Aquatic Dissolved Organic Matter[J]. Environmental Science and Technology, 2003, 37(1): 18A-26A. doi: 10.1021/es032333c [13] JEANNEAU L, ROWLAND R, INAMDAR S. Molecular fingerprinting of particulate organic matter as a new tool for its source apportionment: changes along a headwater drainage in coarse, medium and fine particles as a function of rainfalls[J]. Biogeosciences Discussions, 2018, 15(4): 1-26. [14] MOPPER K, STUBBINS A, RITCHIE J D, et al. Advanced instrumental Approaches for characterization of marine dissolved organic matter: extraction techniques, mass spectrometry, and nuclear magnetic resonance spectroscopy[J]. Chemical Reviews, 2007, 107(2): 419-442. doi: 10.1021/cr050359b [15] AMIOTTE-SUCHET P, LINGLOIS N, LEVEQUE J, et al. 13C composition of dissolved organic carbon in upland forested catchments of the Morvan Mountains (France): Influence of coniferous and deciduous vegetation.[J]. Journal of Hydrology, 2007, 335(3-4): 354-363. doi: 10.1016/j.jhydrol.2006.12.002 [16] ANGRADI T R. Trophic Linkages in the Lower Colorado River: Multiple Stable Isotope Evidence[J]. Journal of the North American Benthological Society, 1994, 13(4): 479-495. doi: 10.2307/1467845 [17] PETERSON B J, HOWARTH R W. Sulfur, carbon, and nitrogen isotopes used to trace organic matter flow in the salt‐marsh estuaries of Sapelo Island, Georgia 1[J]. Limnology and Oceanography, 1987, 32(6): 1195-1213. doi: 10.4319/lo.1987.32.6.1195 [18] TOMING K, TUVIKENE L, VILBASTE S, et al. Contributions of autochthonous and allochthonous sources to dissolved organic matter in a large, shallow, eutrophic lake with a highly calcareous catchment[J]. Limnology and Oceanography, 2013, 58(4): 1259-1270. doi: 10.4319/lo.2013.58.4.1259 [19] LAMBERT T, PIERSON-WICKMANN A C, GRUAU G, et al. Carbon isotopes as tracers of dissolved organic carbon sources and water pathways in headwater catchments[J]. Journal of Hydrology, 2011, 402(3-4): 228-238. doi: 10.1016/j.jhydrol.2011.03.014 [20] BIANCHI T S, FILLEY T, DRIA K, et al. Temporal variability in sources of dissolved organic carbon in the lower Mississippi river[J]. Geochimica Et Cosmochimica Acta, 2004, 68(5): 959-967. doi: 10.1016/j.gca.2003.07.011 [21] FRY B. Natural stable carbon isotope tag traces Texas shrimp migrations[J]. Fish Bull, 1981, 79(2): 337-345. [22] SCHWARCZ H P. Some theoretical aspects of isotope paleodiet studies[J]. Journal of archaeological science, 1991, 18(3): 261-275. doi: 10.1016/0305-4403(91)90065-W [23] PHILLIPS D L, GREGG J W. Source partitioning using stable isotopes: coping with too many sources[J]. Oecologia, 2003, 136(2): 261-269. doi: 10.1007/s00442-003-1218-3 [24] MOORE J W, SEMMENS B X. Incorporating uncertainty and prior information into stable isotope mixing models[J]. Ecology Letters, 2008, 11(5): 470-480. doi: 10.1111/j.1461-0248.2008.01163.x [25] PARNELL A C, INGER R, BEARHOP S, et al. Source partitioning using stable isotopes: coping with too much variation[J]. PloS one, 2010, 5(3): e9672. doi: 10.1371/journal.pone.0009672 [26] PARNELL A C, PHILLIPS D L, BEARHOP S, et al. Bayesian stable isotope mixing models[J]. Environmetrics, 2013, 24(6): 387-399. [27] STOCK B C, JACKSON A L, WARD E J, et al. Analyzing mixing systems using a new generation of Bayesian tracer mixing models[J]. PeerJ, 2018, 6(4). [28] 王毛兰, 张丁苓, 赖建平, 等. 鄱阳湖水体悬浮有机质碳氮同位素分布特征及来源探讨[J]. 中国环境科学, 2014, 34(9): 2342-2350. [29] 陈吉吉, 徐蘇士, 赵靓, 等. 北京密云水库流域水体夏季POM浓度及来源分析[J]. 地球与环境, 2021, 49(2): 157-163. [30] 茅昌平, 肖衡, 王帅, 等. 三峡库区表层沉积物有机碳、氮同位素特征及对有机质来源的指示[J/OL]. 水资源保护: 1-13[2023-03-06]. http://kns.cnki.net/kcms/detail/32.1356.TV.20221026.1622.008.html. [31] 季宁宁, 刘永, 王圣瑞. 洱海悬浮颗粒物和表层沉积物有机碳氮同位素来源特征及水质指示意义[J]. 湖泊科学, 2022, 34(1): 118-133. [32] 岳龙飞, 李洪波, 董丽, 等. 白洋淀入淀河流溶解有机物沿程变化特征及来源解析[J/OL]. 环境工程技术学报: 1-14[2023-03-06]. http://kns.cnki.net/kcms/detail/11.5972.X.20221209.1407.001.html. [33] 张敏, 宫兆宁, 赵文吉, 等. 近30年来白洋淀湿地景观格局变化及其驱动机制[J]. 生态学报, 2016, 36(15): 4780-4791. [34] 王荣欣, 温胜芳, 单保庆, 等. 白洋淀水生植物腐解水质效应与元素去向动态平衡[J]. 环境科学学报, 2022, 42(10): 332-341. [35] 季恺悦, 李琦, 单保庆, 等. 白洋淀沼泽区与开阔水域区颗粒物组分特征与沉降通量研究[J]. 环境科学学报, 2022, 42(8): 271-281. [36] 张杨, 许梦雅, 张超, 等. 白洋淀村落水域沉积物中营养元素和重金属分布特征及风险评价[J]. 环境科学学报, 2021, 41(10): 4074-4085. [37] 胡珊珊, 郑红星, 刘昌明, 等. 气候变化和人类活动对白洋淀上游水源区径流的影响[J]. 地理学报, 2012, 67(1): 62-70. [38] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 254-284 [39] 王雯雯, 郑丙辉, 郑朔方, 等. 呼伦湖水体悬浮颗粒物中有机质的赋存特征及来源解析[J]. 环境科学研究, 2021, 34(3): 558-566. [40] 唐艳凌, 章光新. 基于稳定同位素示踪的流域颗粒有机物质来源辨析[J]. 中国环境科学, 2010, 30(9): 1257-1267. [41] 李慧垠, 王广, 季宏兵, 江用彬. 北京水源地水体中颗粒有机质的碳氮同位素研究[J]. 环境科学学报, 2011, 31(12): 2663-2671. [42] 谭慧娟, 夏晓玲, 吴川, 张全发. 基于碳稳定同位素示踪的金水河颗粒有机碳来源辨析[J]. 生态学报, 2014, 34(19): 5445-5452. [43] 肖化云, 刘丛强. 氮同位素示踪贵州红枫湖河流季节性氮污染[J]. 地球与环境, 2004(1): 71-75. [44] 张俊萍. 利用N、O同位素技术研究太滆运河中氮的分布特征及来源[D]. 淮南: 安徽理工大学, 2015. [45] 赵永松. 庙岛群岛毗邻海域底栖食物网结构特征[D]. 上海: 上海海洋大学, 2022. [46] 龙小虎. 台湾海峡中部夏季水动力情况及悬浮颗粒的分布与输运[D]. 舟山: 浙江海洋大学, 2018. [47] 尹迎身. 基于水质改善的水动力优化方案研究[D]. 郑州: 郑州大学, 2021. [48] 张海涵, 王娜, 宗容容, 等. 水动力条件对藻类生理生态学影响的研究进展[J]. 环境科学研究, 2022, 35(1): 181-190. [49] 李娜, 周绪申, 孙博闻, 等. 白洋淀浮游植物群落的时空变化及其与环境因子的关系[J]. 湖泊科学, 2020, 32(3): 772-783. [50] 徐杰, 何萍, 刘存歧, 等. 白洋淀沉水植物群落时空变化及影响因素[J]. 环境科学研究, 2022, 35(7): 1658-1669. [51] 沈会涛, 刘存歧. 白洋淀浮游植物群落及其与环境因子的典范对应分析[J]. 湖泊科学, 2008(6): 773-779. [52] 林楚翘, 易雨君, 李春晖, 等. 白洋淀浮游生物群落动态变化与生物量模拟研究[J]. 水利水电技术, 2020, 51(12): 169-179. [53] 周绪申, 李娜, 孙博闻, 等. 白洋淀浮游生物群落结构的季节变化及其与环境因子的关系[J]. 水利水电技术(中英文), 2021, 52(8): 110-119. [54] 冀文豪, 郭匿春, 徐军, 等. 长江中游浅水湖泊沉积物碳氮同位素特征及其来源分析[J]. 水生态学杂志, 2018, 39(6): 8-15. [55] KRULL E, HAYNES D, LAMONTAGNE S, et al. Changes in the chemistry of sedimentary organic matter within the Coorong over space and time[J]. Biogeochemistry, 2009, 92(1): 9-25. [56] 易雨君, 林楚翘, 唐彩红. 1960s以来白洋淀水文、环境、生态演变趋势[J]. 湖泊科学, 2020, 32(5): 1333-1347+1226. [57] 王荣欣. 白洋淀典型水生植物腐解水质变化特征与元素释放、归趋分析[D]. 郑州: 华北水利水电大学, 2022. [58] 赵萱. 我国不同生态型湖泊沉积物有机质赋存形态及其与重金属相互作用研究[D]. 济南: 山东师范大学, 2012. [59] 郭长城, 喻国华, 王国祥. 河流泥沙对污染河水中污染物的吸附特性研究[J]. 生态环境学报, 2006, 15(6): 1151-1155. [60] JIN X, ZHANG W Q, et al. Characteristics of suspended particulate matter in a typical slow-moving river of northern China: Insight into its structure and motion behavior[J]. Chemosphere Environmental Toxicology & Risk Assessment, 2018. [61] 王栋, 陈伯俭, 金鑫. 滦河不同季节悬浮颗粒物特征差异及原因解析[J]. 水电能源科学, 2021, 39(7): 76-80. [62] 翟亮, 金鑫, 陈伯俭, 等. 河流水环境及水动力条件差异对悬浮颗粒物表观特征的影响[J]. 中国农村水利水电, 2022, 477(7): 50-54. -



 下载:
下载:







