-
低耗、高效的反硝化除磷技术一直是废水生物脱氮除磷领域的研究热点之一[1-2]。然而, 已有研究[3]过多地关注反硝化除磷工艺效能而忽略了在微生物学方面的深入研究。尽管以往有研究者对反硝化除磷菌(denitrifying polyphosphate-accumulating organisms, DPAOs)进行了研究[4-5], 但受限于当时的微生物检测技术, 对反硝化除磷菌的研究仍不够深入。高通量测序技术作为新型微生物种群鉴定技术, 具有分析结果准确、高速、高灵敏度和高自动化等特点, 可以准确的分析生物多样性, 故广泛应用于环境微生物鉴定领域[6-7]。因此采用高通量测序技术作为考察反硝化除磷微生物群落演替规律的手段不失为一个良好的技术选择, 但同时微生物在系统中的种群特征的研究也有待进一步的深入开展。已有的研究表明, 在反硝化除磷系统中的一些优势菌属, 如气单胞菌属(Aeromonas)、假单胞菌属(Pseudomonas)、肠杆菌科等都具有反硝化除磷功能[8], 它们的存在为解释系统效能的变化提供了理论支撑。
厌氧折流板反应器(anaerobic baffled reactor, ABR)具有构造简单、能耗低、抗冲击负荷能力强、处理效率高以及可实现生物相分离等优点[9-10], 膜生物反应器(membrane bioreactor, MBR)则具有利于世代时间长的硝化细菌的增殖, 从而提高硝化效率的优点[11]。因此, 采用ABR-MBR研究反硝化除磷工艺在培养DPAOs以及研究不同功能区微生物的细菌群落特征方面具有显著优势[12]。
本研究采用Miseq高通量测序手段对ABR-MBR组合工艺中除磷功能区的细菌群落特征进行分析, 以期从微生物多样性、种群丰度及优势菌群分布方面为系统效能的变化提供理论支撑, 为反硝化除磷工艺应用于工程实践提供理论依据, 为开发新型的脱氮除磷工艺提供技术支持。
HTML
-
本研究采用的ABR-MBR如图 1所示, 该一体化反应器由7格室ABR和好氧MBR串联而成, 材质均采用有机玻璃, 总有效容积11.4 L, 其中ABR和MBR的有效容积分别为7.6 L和3.8 L。ABR中的A1格室进行水解发酵产生优质碳源, A2~A4格室均为厌氧释磷区, A5~A7格室均为缺氧吸磷区, MBR为好氧区。
-
实验用水为苏州某高校生活污水, 采用葡萄糖、淀粉、蛋白胨及碳酸氢铵、磷酸二氢钾作为补充碳源、氨氮和磷, 如表 1所示。
本研究污泥样品取自ABR除磷功能区。为保证反硝化除磷菌适宜生存的温度, ABR水浴维持温度(30±2) ℃。启动初期, A1及A4接种取自本实验室自培养的具有良好除碳性能的污泥, MLSS约为7 800 mg·L-1, SVI为85 mL·g-1。MBR及除磷功能区(A2、A3、A5~A7)接种自苏州市某污水处理厂A2/O工艺的二沉池, 具有良好的硝化及除磷能力, MLSS分别为3 200 mg·L-1和4 020 mg·L-1, SVI分别为80 mL·g-1和75 mL·g-1, 污泥沉降性能良好。
-
吕亮等[13]发现提高硝化液回流比对ABR-MBR系统中反硝化除磷效能有促进作用, 故本研究系统的启动主要采用固定污泥回流比, 逐步提高硝化液回流比的方法。控制进水有机负荷(COD)为0.8 kg·(m3·d)-1, ABR水力停留时间(HRT)为12 h, MBR的HRT为6 h, 控制反硝化除磷功能区(A2、A3、A5~A7)污泥龄(SRT)为25 d, 污泥回流比R1和R2为80%, pH在7.1~7.4, 保持MBR的DO在1~2 mg·L-1, 硝化液回流比R3从150%逐步提升至300%并最终稳定在300%。
-
反应器运行期间, 定期采集水样经0.45 μm中性滤纸过滤后, 按照国家环保部规定的标准方法《水质和废水监测分析方法》[14]对COD、NH4+-N、NO2--N、NO3--N、PO43--P、TN等指标进行测定分析, COD采用快速消解法; NH4+-N采用纳氏试剂光度法; NO2--N采用N-(1-萘基)-乙二胺分光光度法; NO3--N采用紫外分光光度法; PO43--P采用钼锑抗分光光度法; TN采用过硫酸钾氧化-紫外分光光度法; MLSS采用滤纸称重法。
-
取启动初期以及稳定运行期的ABR除磷功能区的污泥, 污泥经过多点采样混合作为该功能区样品, 启动初期至稳定运行期(10、25和60 d)的污泥样品对应编号为M1、M2和M3。采用16S RNA基因V3~V4区通用引物(338F/806R), PCR扩增测序区域为338F/806R。引物名称和引物序列分别是338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)[15]。采样PCR仪(ABI GeneAmp 9700型)对细菌16S rRNA基因进行PCR扩增。
1.1. 实验装置
1.2. 实验水质和接种污泥
1.3. 实验方案和运行参数
1.4. 水质指标的检测和方法
1.5. Miseq高通量测序分析方法
-
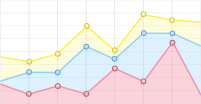
ABR-MBR对系统正磷酸盐的去除效果如图 2所示。由图 2可知, 进水磷酸盐浓度在6.25~ 8.65 mg·L-1, 进水总氮浓度在50.11~67.78 mg·L-1, 逐步提升硝化液回流比从150%至300%, 在系统运行的第1个月, 系统磷酸盐去除效果较差, ABR-MBR平均出水正磷酸盐浓度在4.11 mg·L-1左右, 并且在启动初期的时候磷酸盐几乎没有去除。由于启动初期系统具备一定的缺氧吸磷能力, 说明接种污泥中含有较多的聚磷菌并且含有一定量的DPAOs; 系统运行至25 d时, 对正磷酸盐的去除率为50%左右, 对总氮的去除率则在30%左右, 说明系统中已经存在一定量的反硝化除磷菌并且此时的条件是适宜其生存以及增长的; 直至系统运行第40天之后, 硝化液回流比稳定在300%, 此时, ABR-MBR中平均出水正磷酸盐浓度由4.11 mg·L-1降为0.6 mg·L-1左右, 平均出水总氮浓度由30.8 mg·L-1降为17.4 mg·L-1左右, 系统对正磷酸盐和总氮的去除率分别为91.8%和70.2%, 并且之后的正磷酸盐去除率一直维持在90%以上, 平均出水磷浓度为0.45 mg·L-1, 总氮的去除率一直维持在70%以上, 平均出水氮浓度为15.6 mg·L-1, 系统具有稳定高效的反硝化除磷能力。因此, 逐步提升硝化液回流比是ABR-MBR组合工艺实现反硝化除磷的主要原因。
-
利用Miseq平台对ABR除磷功能区启动初期至稳定运行期(10、25和60 d)的3个样品进行高通量测序, 分别获得39 808、33 309、37 197条优化序列, 将优化序列在97%的相似性下聚类, 分别获得OTU 651、690、706个(见表 2), 且3个样品的物种覆盖度(coverage)均大于99%, 表明了此次高通量测序的结果能够代表样本中微生物的真实情况。
Chao、ACE、Shannon、Simpson指数表明系统中除磷功能区细菌群落、物种的丰富度和多样性, 其中丰富度指数Chao和ACE可以估算群落中含OTU数目的指数, 反映系统种群的丰富度, 在生态学中常用来估计物种总数, 值越大代表物种总数越多[16]。由表 2可知, 3个样品的Chao、ACE指数均为M3 > M2 > M1, 结果表明, 在启动阶段至稳定运行期细菌群落的丰富度总体上呈上升趋势。Shannon指数反映基于物种数量的群落种类多样性, 指数越大表明群落的复杂程度越高[17], Shannon指数为M1 > M3 > M2, 随着工艺的运行, Shannon指数在启动期至稳定前期出现了明显的下降, 而在稳定期有所上升, 这可能是由于接种污泥中的微生物种类较为丰富, 随着DPAOs的富集, 竞争能力弱的菌群将逐渐减少, 造成群落结构逐渐集中化, 但随着功能性反硝化除磷菌逐渐占据主导地位, 且功能性微生物的多样性同比增加。Simpson指数也是用来估算样本中微生物多样性的指数[7], 该指数中稀有物种所起的作用较小, 而普遍物种所起的作用较大。Simpson指数值越大, 说明优势微生物占总生物量的比例越大[18], 如表 2所示, Simpson指数逐渐增大, 说明随着硝化液回流比的逐步提升, 系统中优势微生物占总生物量比重增大。同时反应器运行25 d后较启动初期Simpson指数大幅度增大, 当系统近乎稳定运行之后, Simpson指数缓慢上升, 说明当反应器稳定运行之后, 系统除磷功能区的优势微生物逐渐凸显并且微生物群落越来越稳定。由于该工艺具备的优势可为反硝化除磷菌提供良好的生存条件, 使反硝化除磷菌逐渐富集并淘汰掉弱势菌群, 可有效的进行脱氮除磷, 因而在稳定运行期, 系统对磷的去除率高达90%以上, 对总氮的去除率高达72%以上。因此, 随着硝化液回流比的逐步提升, 系统除磷功能区的微生物种群的丰度指数和多样性指数均较高, 并且系统的微生物的种群结构也越来越稳定, 保证了ABR-MBR组合工艺的稳定运行。
-
污泥样品在门水平的微生物种群组成如图 3所示, 系统中除磷功能区的细菌群落结构多样性较为丰富, 主要存在8~9个门, 按照丰富度排列主要存在变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、绿菌门(Chlorobi)等, 并以变形菌门, 绿弯菌门, 厚壁菌门和拟杆菌门的微生物为主, 四者的丰度比例约占总细菌的82.38%~84.32%, 并且3个样品中的优势菌群均来自变形菌门。如图 3所示, 变形菌门的丰度分别为55.13%、29.51%、52.23%;绿弯菌门的丰度分别为8.36%、26.62%、13.98%;厚壁菌门丰度分别为11.13%、20.50%、9.59%;拟杆菌门的丰度分别为7.76%、7.69%、7.35%。从中可知, 随着硝化液回流比的逐步提升, 变形菌门一直为系统中的优势菌群, 且占有系统最大丰度比例。国内外研究表明, 大多数具有脱氮除磷功能以及反硝化除磷功能的微生物均归属于变形菌门[19], 部分归属于拟杆菌门[20], 从门水平上的丰度变化来看, 厚壁菌门在系统中也占据一定的比例, 其中厚壁菌门中的芽孢杆菌具有较强的抵抗外界有害因子的能力[21]并且其具有促硝化作用, 能够降解废水中的氨氮[18], 因此对废水中的氮的去除以及维持系统稳定具有较大的贡献[22]。
本研究主要探讨除磷功能区的微生物种群结构, 由测序结果可知, 变形菌门和拟杆菌门为系统的优势菌群, 并且具有除磷功能的微生物主要集中于变形菌门, 少量存在于拟杆菌门。
为进一步探索反硝化除磷微生物所在的变形菌门在随着硝化液回流比逐步提升条件下微生物的分布特征, 故对除磷功能区变形菌门在纲分类水平的分布特征分别进行分析, 结果见表 3。3个样品中β-变形菌纲(Bataproteobacteria)和γ-变形菌纲(Gamaproteobacteria)是变形菌门中占据比例较大的菌群, 占细菌总量的比例约为81.57%~88.26%。另外已有研究[23-25]表明, β-变形菌纲和γ-变形菌纲中均存在部分反硝化除磷菌, 有利于去除废水中的磷和其他污染物, 在系统生物脱氮除磷方面起到重要的作用, 而变形菌门中δ-变形菌纲(Deltaproteobacteria)和α-变形菌纲(Alphaproteobacteria)的丰度相对较低。
-
为进一步阐明工艺运行过程中细菌群落的变化情况, 在属的水平上, 选取系统中占有比例最多的具有脱氮除磷功能的γ-变形菌纲进行分析。由图 4可知, 随着系统的运行, 稳定运行期样品中功能性脱氮除磷微生物主要属类为气单胞菌属(Aeromonas)、假单胞菌属(Pseudomonas)、肠杆菌科细菌属(Enterobacteriaceae)等。此外, 在β-变形菌纲还存在一定数量的Thauera、Denitratisoma和红环菌科细菌(Rhodocyclaceae), 在拟杆菌门还检测出了少量的黄杆菌属(Flavobacterium)和鞘脂杆菌纲细菌。已有研究[26-28]显示, 气单胞菌属、假单胞菌属、红环菌科细菌、黄杆菌属等均为常见的反硝化除磷优势菌; 熊付娟[29]通过对反硝化除磷污泥特性的研究发现系统中主导菌属为Thauera, 并且发现该菌属具有反硝化功能; 此外, Denitratisoma也是一种具有反硝化功能的菌属[30], 它们的存在为系统同时反硝化脱氮除磷效果提供了保障。
由结果可知, 当系统运行稳定之后, 主要功能性除磷微生物主要来自变形菌门下的γ-变形菌纲, 其中相对丰度最大的菌属为气单胞菌属, 并且在启动初期至系统稳定运行的过程中, 气单胞菌属在γ-变形菌纲的相对丰度由5.30%上升至41.49%, 与此同时, 系统的正磷酸盐去除率逐步稳定在90%以上。此外, 从图 4可以看出, 由M1至M2, Candidatus competibacter的数量显著增多, 此时虽然系统中气单胞菌属的相对丰度达到了41.2%, 但系统磷酸盐去除率却只有51.8%, 据有研究报道, Candidatus competibacter是聚糖菌[31]的一种, 它的存在会与PAO竞争碳源从而不利于磷酸盐的去除, 这也是导致系统脱氮除磷效果一直得不到提高的原因。随着硝化液回流比的逐步提升, Candidatus competibacter的相对丰度由44.5%下降至8.0%, 系统除磷效果也逐渐提升。
图 5所示为ABR-MBR中反硝化除磷菌菌属总量的分布规律。从启动初期(10 d)至稳定运行(80 d)过程中, 反硝化除磷菌属占总生物量的比例在逐渐增加, 由最初的1.57%上升至10.22%。相对来说, 气单胞菌属的增加幅度较大, 而其余功能性菌属增加的幅度普遍较小并且以较低的丰度水平存在于系统之中, 也就是说系统中功能性除磷微生物丰度越来越大, 同时随着系统中优势微生物丰度的增大, 系统的磷酸盐去除率和总氮去除率也逐步上升并分别稳定在90%和72%以上。总的来说, 功能性除磷菌属的丰度呈现大幅度上升的趋势, 为系统整体脱氮除磷效果的提升提供了保证。
傅以钢等[32]对除磷工艺中的聚磷菌种群结构进行了研究, 结果表明变形杆菌在除磷系统中占据了比较重要的地位, 这与本研究中反硝化除磷工艺生物群落的特征是一致的, 其在缺氧/好氧条件下属水平上占优势的菌属为Bdellovibrio sp.、Dechloromonas sp.、Neisseria sp.、Thauera sp.等, 在厌氧/好氧条件下的优势菌属为Dechloromonas sp.、Pseudomonas sp.等, 其中Thauera sp.以及Pseudomonas sp.菌属也是本研究中的优势菌属, 而Bdellovibrio sp.和Neisseria sp.等菌属为其工艺条件下独有的优势菌属。因此, 反硝化除磷工艺与聚磷菌除磷工艺微生物群落虽有相似之处但也存在着差异。吴昌永等[33]的研究结果也表明随着进水水质及工艺运行工况的改变, 系统中微生物群落特征也会发生改变, 同时微生物种群结构呈现出一种动态的演替过程。可见, 工艺条件与微生物群落结构之间存在着显著的映射关系。
2.1. ABR-MBR运行状况分析
2.2. Miseq高通量测序结果分析
2.2.1. 微生物种群多样性分析
2.2.2. 门水平优势微生物分析
2.2.3. 属水平优势微生物种群分析
-
1) 在ABR-MBR组合工艺中, 控制温度为(30±2) ℃, pH为7.1~7.4, 保持MBR中的DO在1~2 mg·L-1, 逐步提升硝化液回流比从150%至300%, 可促进反硝化除磷菌大量富集, 实现系统的启动以及稳定运行。在硝化液回流比稳定在300%时, 系统总磷和总氮去除率分别维持在90%和72%以上。
2) ABR-MBR工艺中反硝化除磷微生物以变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为主, 分别占29.51%~55.13%和7.35%~7.76%, 其中变形菌门功能性微生物主要集中在γ-变形菌纲(Gamaproteobacteria), 以气单胞菌属(Aeromonas)和假单胞菌属(Pseudomonas)为主要组成; 而拟杆菌门中以黄杆菌属(Flavobacterium)为主导。其中气单胞菌属(Aeromonas)增幅最大, 其在γ-变形菌纲(Gamaproteobacteria)的相对丰度由5.30%上升至41.49%。
3) 工艺运行过程中细菌群落多样性逐渐增加, 系统内部菌群结构也趋于稳定, 系统中功能性除磷微生物的多样性和稳定性为系统脱氮除磷效果提供了保证。
4) ABR-MBR组合工艺运行过程中的去除效果与功能性反硝化除磷菌的相对丰度密切相关, 当系统中反硝化除磷菌总量由1.57%上升至10.22%时, 系统的总磷去除率上升至90%以上。









 DownLoad:
DownLoad:
