-
溶解性固体总量(total dissolved inorganic salt,TDS)的质量分数大于1%的含氮废水通常称为高盐含氮废水[1]。目前,高盐含氮废水排放量大且来源广泛,如腌制食品工业[2]、海产品加工[3]、皮革生产[4]等。由于来源不同,高盐含氮废水的性质复杂各异,不仅含有氮、磷等营养元素和中低碳链的有机物,也含有高浓度的
${\rm{SO}}_4^{2 - }$ 、Cl−、Ca2+、Mg2+、Na+等无机离子,是一种污染严重且处理难度较大的废水。传统的膜分离法、电解法、离子交换法虽能去除盐度,但对污染物的降解效果甚微。MFCs微生物燃料电池(microbial fuel cells,MFC)是一种新型废水处理技术,因能以产电微生物作为催化剂,氧化水中污染物并且实现化学能向电能的转换而备受国内外关注。研究者们对MFCs性能的考察,最初主要集中于低盐条件下的废水处理、营养物质回收或生物传感设备。2002年,TENDER等[5]将阳极嵌入海洋沉积物中,阴极置于上覆海水中,利用沉积微生物的活动在水-沉积物表面形成电压梯度,产生电能,实现了MFC在高盐环境下产电的可能性,为高盐废水的处理提供了新思路。盐度会对MFC的性能产生影响。LIU等[6]研究发现,当离子强度由100 mmol·L−1增加到400 mmol·L−1时,以乙酸钠为碳源的单室MFC的产电性能便得以改善; TREMOULI等[7]考察了盐度对COD去除率的影响,发现当盐度从2.7 g·L−1增加至6.7 g·L−1时,COD的去除率从70%下降至52%;黄志鹏[8]研究了盐度分别对单室MFC中
${\rm{NH}}_4^ + $ -N、${\rm{NO}}_3^ - $ -N和${\rm{NO}}_2^ - $ -N的处理效果影响,发现随着盐度的增加,${\rm{NH}}_4^ + $ -N的去除率逐渐减小,而${\rm{NO}}_3^ - $ -N和${\rm{NO}}_2^ - $ -N的还原速率呈现先升高后降低的趋势。目前,MFC处理高盐废水的研究大多集中于盐度对电池产电性能以及有机物去除的影响方面,而对高盐条件下同步硝化反硝化除氮的影响还鲜见报道。为优化以高盐含氮废水为底物的MFC的性能,并为今后MFC应用于实际废水提供参考,本研究根据实际废水的水质变化情况,设置了5组不同碳氮比(C/N分别为3∶1、4∶1、5∶1、6∶1和7∶1)的高盐模拟废水作为单室MFC的底物,探讨了碳氮比对单室MFC产电性能、COD去除率以及同步硝化反硝化脱氮的影响,同时,通过高通量测序技术对接种泥和电极生物膜进行了检测,并对优势菌种进行了分析,以进一步为高盐含氮废水的处理提供参考。
HTML
-
单室无膜空气阴极MFC装置如图1所示。反应器由有机玻璃板构成,长×宽×高为60 mm×60 mm×70 mm,腔体有效体积为252 cm3。阳极采用有效面积为36 cm2的正方形碳毡,其尺寸为60 mm×60 mm。阴极采用有效面积为42 cm2的长方形碳能碳布,其尺寸为60 mm×70 mm。 阴阳极均由钛丝引出,并经铜导线与电阻箱连接构成闭合回路。外电阻设置为1 000 Ω,电池运行过程中,采用磁力搅拌器对电极液进行搅拌,并在反应器的上部预留直径为8 mm的圆孔用于电极液的更换。
电极材料在使用前需进行预处理。碳布的处理步骤如下:首先在碳布的疏水侧均匀涂抹20%的聚四氟乙烯乳液,待液体凝固后,置于370 ℃的马弗炉中烘烤15min,以上步骤重复4次;其次,在碳布的亲水侧做催化处理,将20%的Pt/C催化剂、异丙醇、去离子水及Nafion黏接剂按照一定比例混合后均匀涂抹于碳布的有效范围,再在70 ℃烘箱中烘烤2 h。其中,Pt/C催化剂的使用量取决于催化剂的浓度和有效面积,本研究采用催化剂浓度为0.5 mg·cm−2,因此,Pt/C催化剂的使用量为21 mg;异丙醇、Nafion黏接剂以及去离子水的使用量与Pt/C催化剂的使用量有关, 每mg Pt/C催化剂需0.83×10−6 L异丙醇溶液、6.67×10−6 L Nafion黏接剂、3.33×10−6 L去离子水,因此,异丙醇、Nafion黏接剂和去离子水的使用量分别为69.93×10−6、140.07×10−6和17.43×10−6 L。碳毡需采用1 mol·L−1的硫酸、1 mol·L−1的氢氧化钠及无水乙醇依次浸泡12 h,以去除碳毡表面的颗粒污染物和金属离子。
-
在常规的污水处理系统中,相比于进水中氮的含量,进水中有机物浓度的变化幅度更大。因此,本研究依据榨菜废水处理厂厌氧池出水中污染物的浓度变化情况,在碳氮比的设置中,固定氮的浓度,再根据不同碳氮比确定COD值。实验所采用的水样均为模拟废水,氮源由NH4Cl(0.497 g·L−1)提供、碳源由CH3COONa提供,CH3COONa的使用量依据碳氮比确定,当碳氮比分别为3∶1、4∶1、5∶1、6∶1、7∶1时,CH3COONa的使用量依次为0.50、0.67、0.83、1和1.17 g·L−1,其余成分主要包括CaCl2 0.208 g·L−1、KCl 0.1 g·L−1、MgSO4·7H2O 0.1 g·L−1、Na2SO4 0.23 g·L−1、KH2PO4 0.176 g·L−1,模拟废水均用NaCl调至TDS为15 g·L−1。配水在4 ℃的冰箱内保存。配水水质特征如表1所示。
-
同时启动5套单室无膜空气阴极MFCs,记为1#、2#、3#、4#和5# MFC,分别以碳氮比为3∶1、4∶1、5∶1、6∶1和7∶1的模拟废水为电极液,实验采用序批式模式运行。在启动阶段,分批次向反应器中接种15 mL取自井口污水厂且经实验室培养的反硝化污泥,并使电极液充满整个反应器腔室,当电池运行电压降至50 mV以下时则视为完成1个产电周期,并及时更换新鲜电极液。若连续3个周期电池均能达到相似电压,则认为MFCs启动成功。再向反应器中接种10 mL取自榨菜废水处理厂且经实验室培养的高盐硝化污泥,待出水水质稳定,采集实验数据。为保持反应器的厌氧状态,电极液在更换前需用氮气吹脱10 min,并且换液孔需用胶带密封。
-
电池输出电压(U,mV)通过PISO数据采集器(中国台湾泓格科技公司)进行采集,采集频率为1 min·次−1,并记录于存储设备;开路电压和阴阳极电势采用UT39A数字万用表测得。极化曲线和功率密度曲线通过变电阻法测得。电流、功率密度和库仑效率根据式(1)~式(3)进行计算。
式中:I为电流,mA;PV为功率密度,mW·m−3;CE为库仑效率,%;R为外电路电阻,Ω;VAn为反应器有效体积,m3;
$M_{{\rm{O}}_2} $ 为以氧为标准的有机物摩尔质量,32 g·mol−1;F为法拉第常数,96 485 C·mol−1;b为以氧为标准,氧化1 mol有机物需要转移的电子数,取值4 mol;D为在时间0~t内COD的变化,g·mol−1。水质检测指标和方法包括COD(重铬酸盐法);氨氮(纳氏试剂比色法);硝态氮(氨基磺酸紫外分光光度法);亚硝氮(N-(1-萘基)-乙二胺光度法);总氮(碱性过硫酸钾消解紫外分光光度法)。盐度通过电导率仪(FE-30K,Metter-Toledo)进行检测,pH和溶解氧通过便携式仪器进行检测。
-
接种污泥的取样:驯化成功后,取少量接种污泥,在4 ℃环境下以10 000 r·min−1离心15 min,然后将样品保存在−80 ℃冰箱中。电极生物膜的取样:待实验结束,将电极生物膜从单室MFC中取出,用手术刀剪裁成检测所需尺寸后,保存在−80 ℃冰箱中。使用E.Z.N.A.®土壤DNA试剂盒(Omega Bio-tek,Norcross,GA,USA)提取接种污泥和电极生物膜DNA,采用16S rRNA基因测序技术对样本进行检测并对优势菌种进行分析。接种污泥及电极生物膜样品交至上海美吉生物平台(上海,中国),由该公司通过PCR扩增技术进行高通量测序。
1.1. 单室MFC的制作
1.2. 模拟高盐废水
1.3. 电池启动与运行
1.4. 检测方法和指标
1.5. 高通量测序分析方法
-
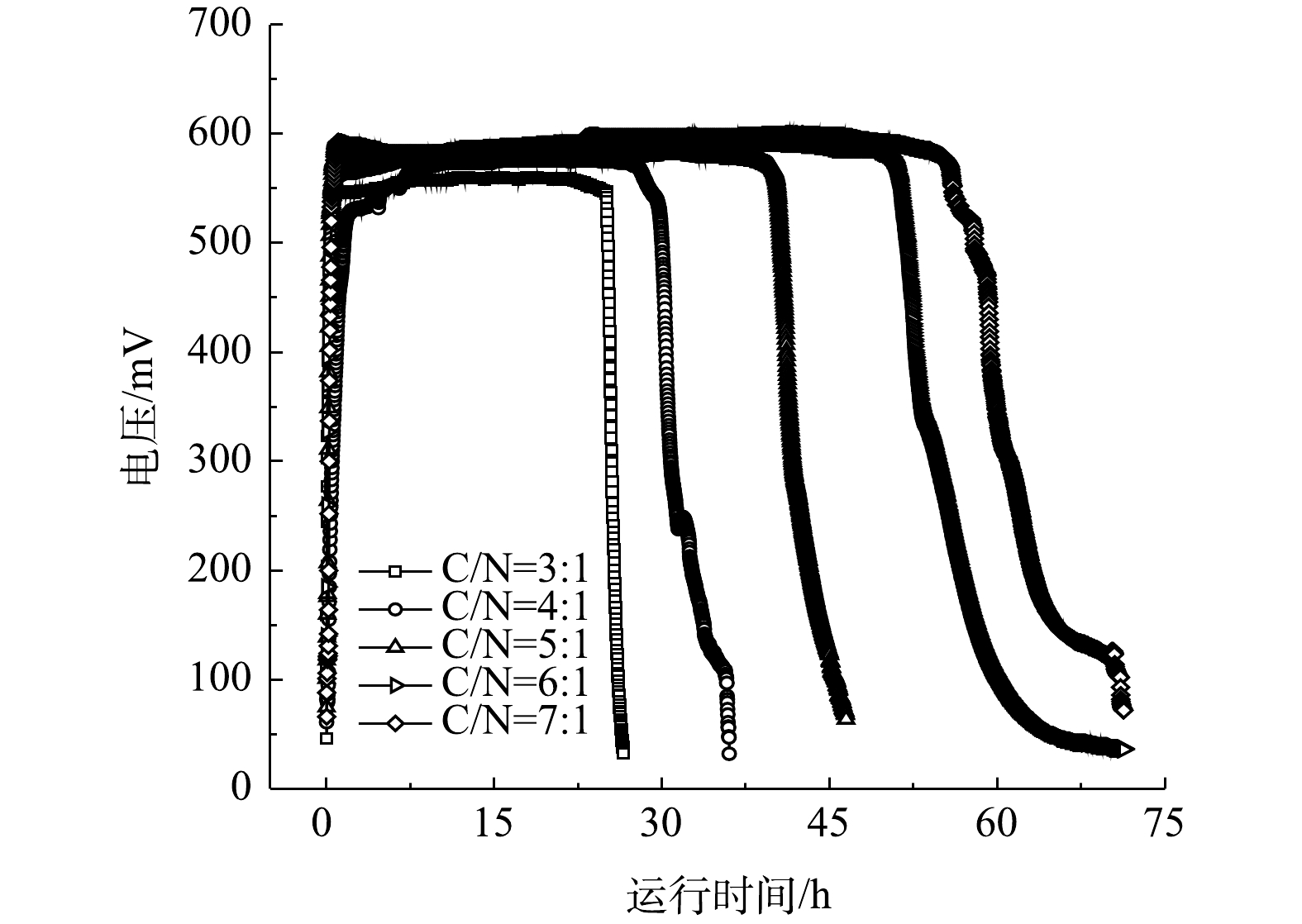
以不同碳氮比的模拟废水为底物的单室MFCs的输出电压如图2所示。由图2可以看出,MFCs经换水后均可以迅速达到峰值电压并维持稳定。碳氮比分别为3∶1、4∶1、5∶1、6∶1和7∶1的单室MFCs的产电周期和峰值电压存在差异,电池的最高输出电压依次为552、576、588、606及610 mV,产电周期长依次为26、36、48、60和71 h。其原因是,碳氮比的提高使电极微生物可利用底物浓度增大,同时也使得反应器厌氧环境相应增强,电极微生物的活性提高,从而促进其对底物的利用。
当电池连续稳定运行5个周期后,通过变电阻法测定电池的功率密度曲线和极化曲线,结果如图3所示。在5个碳氮比水平下单室MFCs的开路电压和内阻分别为:688 mV和90 Ω、713 mV和87.6 Ω、740 mV和81.6 Ω、749 mV和80.9 Ω、765 mV和78.4 Ω(图3(a)和图3(b));相应的最大功率密度依次为5.17、5.71、6.48、6.97和7.33 W·m−3(图3(b))。黄浩斌等[9]开发的单室MFC在盐度为20 g·L−1的条件下的最大输出功率为1.11 W·m−2。系统的极化由阴阳极极化共同决定,5套MFCs系统的阳极电势均随着电流密度的增大,出现逐渐加重的极化现象,而阴极电势呈现平缓的极化现象,这说明阳极电势的改变比阴极电势更能影响单室MFCs的电压。产生以上现象的主要原因是:碳氮比的增加可有效促进溶液中离子的迁移,电极生物膜为了适应电极液底物浓度的变化,传质内阻和活化内阻降低,功率密度增大,从而造成电池性能的提升。
-
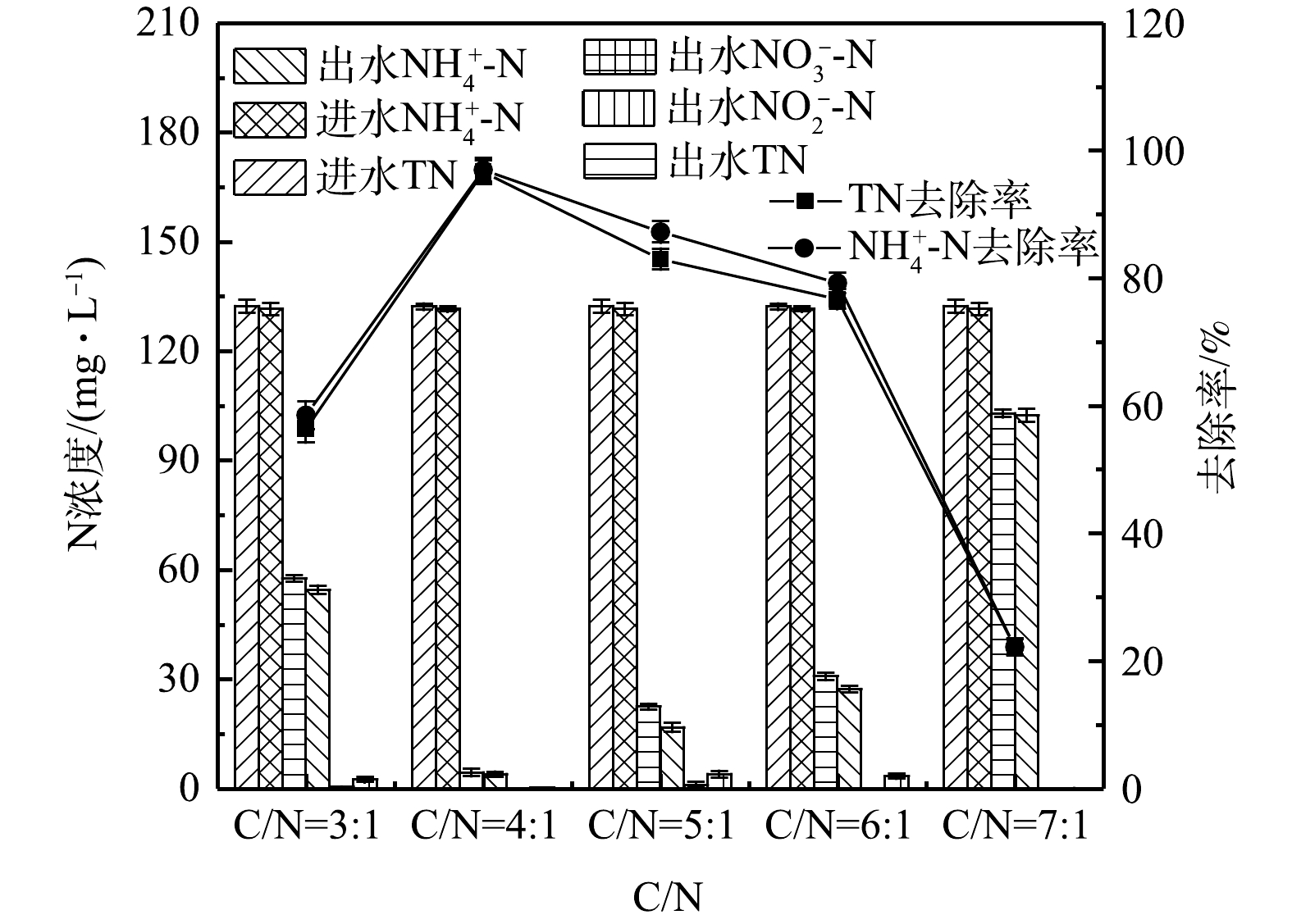
由图4可以看出,当5组单室MFCs的进水中仅含有
${\rm{NH}}_4^ + $ -N并且${\rm{NH}}_4^ + $ -N浓度保持在(131.53±1.7) mg·L−1时,电池稳定运行的周期出水中,均没有${\rm{NO}}_3^ - $ -N的积累,1#、3#和4#MFCs中有少量的${\rm{NO}}_2^ - $ -N,说明该单室MFC在高盐条件下可以实现同步硝化反硝化脱氮。当碳氮比为4∶1时,TN的去除效果最佳,${\rm{NH}}_4^ + $ -N和TN的去除率高达(96.98±1.8)%和(96.64±1.8)%;当碳氮比为5∶1和6∶1时,${\rm{NH}}_4^ + $ -N和TN的去除率有所下降,但仍在75%以上;而当碳氮比为7∶1时,${\rm{NH}}_4^ + $ -N和TN的去除率仅为(22.21±1.2)%和(22.18±1.3)%。导致以上现象的原因可能是:单室MFCs的接种源以好氧反硝化菌Thauera为主。有研究[10-12]表明,Thauera也能够进行异养硝化;同时,COD的增加并没有抑制
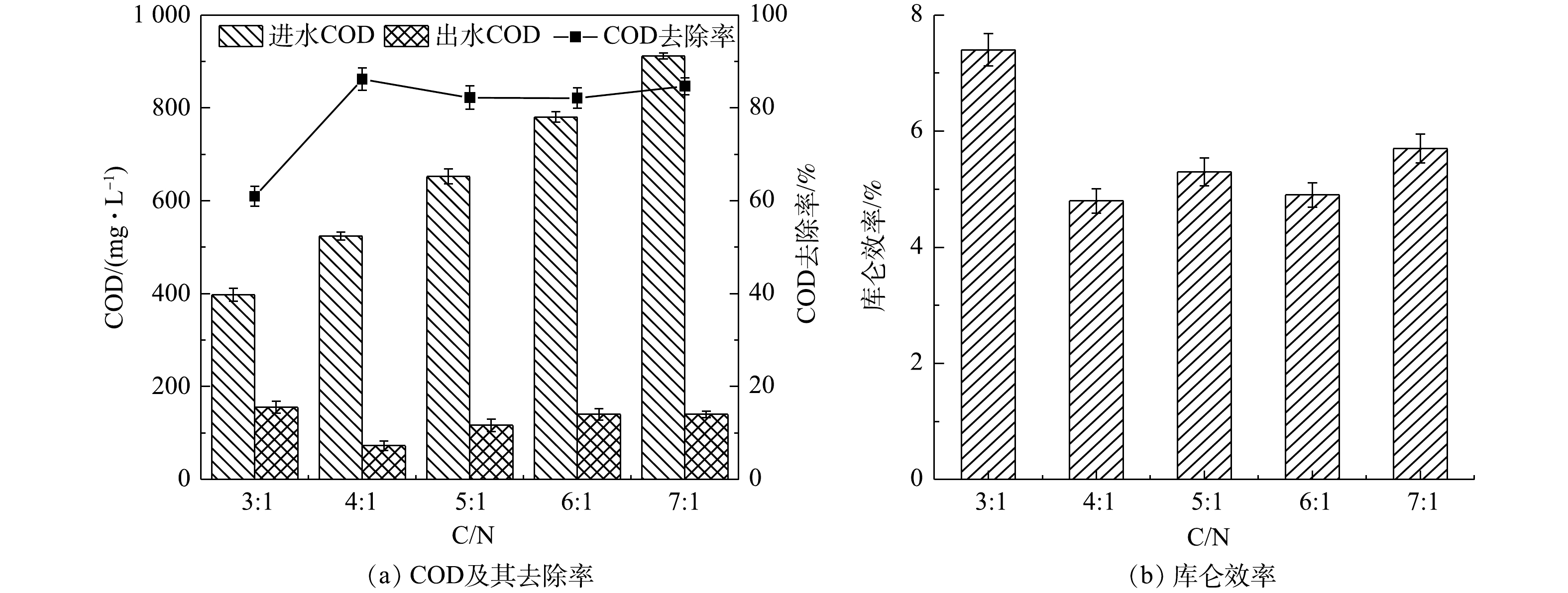
${\rm{NH}}_4^ + $ -N对氧气的利用,推测除了传统的自养硝化作用,异养硝化可能是${\rm{NH}}_4^ + $ -N的主要转换途径,而有机物浓度是影响异养硝化效率的重要因素[13],高浓度的有机物有利于异养硝化菌的生长代谢;此外,产电周期过短也可能限制${\rm{NH}}_4^ + $ -N的降解。因此,当碳氮比由3∶1升至4∶1时,底物浓度增加,碳源更加丰富,产电周期延长,脱氮效果显著提高。而当碳氮比为7∶1时,${\rm{NH}}_4^ + $ -N和TN的去除率低于25%,这可能是因为系统中其他异养菌大量富集,加剧了对耗氧有机物(以COD计)的竞争作用,导致系统的脱氮功能受到抑制。由图5(a)可得,当碳氮比从3∶1升高至4∶1时,COD的去除率从(60.93±2.1)%增加至(86.17±2.4)%,而当碳氮比继续升高至7∶1,COD的去除率分别为(82.18±2.5)%、(82.10±2.1)%、(84.68±1.8)%。这可能是因为:一方面随着碳氮比的增加,单位面积的微生物活性增强[14],降解耗氧有机物(以COD计)并且进行新陈代谢的能力也提高,但当电极微生物与底物结合的酶数量达到饱和状态,即使继续增加碳氮比,COD的去除率也不再提高;另一方面,在同时脱氮除碳的单室MFCs系统中,氮的去除过程也需要消耗有机物,而在不同碳氮比环境下,菌种间对有机物的竞争作用存在差异,从而影响有机物及氮的去除效果。乔龙胜[14]以不同浓度的人工配水为单室MFC的底物时COD的去除率仅为42.64%~55.90%。
1#~5#MFCs的库仑效率分别为7.4%、4.8%、5.3%、4.9%、5.7%(图5(b))。LIU等[15]以醋酸盐作为空气阴极单室MFCs的底物时库仑效率高达28.3%,这说明在本研究的反应器中除发电以外的其他过程消耗了大量的耗氧有机物(以COD计)。对以上结果的原因分析如下:首先,5组单室MFCs均没有采用质子交换膜,为氧气的渗入提供了便利,部分有机物被氧气消耗,导致库仑效率降低,LIU等[16]的研究表明,不使用质子交换膜的MFC的氧气通量比使用质子交换膜的MFC高2.7倍;其次,1#MFC表现出比其他MFCs更高的库仑效率,这可能与电极微生物优先利用溶液中的耗氧有机物(以COD计)进行产电有关,2#、3#和4#电池库仑效率降低可能是因为部分耗氧有机物(以COD计)作为碳源被反硝化菌消耗,而5#MFC反应器中可能富集了大量其他异养菌,加剧了对耗氧有机物(以COD计)的竞争,库仑效率降低。
-
在MFCs运行的一个完整周期,以4 h为间隔,对电极液水质进行检测,结果如图6所示。由图6可以看出,在不同碳氮比条件下,单室MFCs体系中DO的浓度各不相同,且对耗氧有机物(以COD计)和
${\rm{NH}}_4^ + $ -N的降解过程存在差异,但污染物的变化趋势具有一致性,这说明单室MFCs可以实现电极液中有机物的自动分配。表2和表3分别表示${\rm{NH}}_4^ + $ -N和耗氧有机物(以COD计)在不同运行阶段的降解速率。结果表明:在周期运行的初始阶段,电极液中底物充足,电极微生物对耗氧有机物(以COD计)的竞争作用较弱,耗氧有机物(以COD计)和${\rm{NH}}_4^ + $ -N均以较大速率降解;而随着运行时间的增加,底物浓度降低,单位面积的微生物活性减弱,降解耗氧有机物(以COD计)并且进行新陈代谢活动的能力也受到影响,导致COD的去除速率降低,同时由于系统中电极微生物对耗氧有机物(以COD计)的竞争作用逐渐加强,${\rm{NH}}_4^ + $ -N的降解速率也减缓;在周期运行的后期,COD值继续降低,一方面,产电微生物活性减弱使传递到阴极的电子数量减少,另一方面,可用于消耗通过碳布扩散进入电池的氧气的耗氧有机物(以COD计)不足,导致氧气在电池中的不断累积。詹亚力等[17]向MFC中更换含有饱和溶解氧和不含溶解氧的醋酸钠溶液,发现高含量的氧气不利于电池电能的输出,因此,氧气浓度的增加反过来又对阳极产电微生物起到一定的抑制作用。1#、2#、3#和4#MFCs在电池运行的后期出现${\rm{NH}}_4^ + $ -N降解速率的小幅提高可能与反应器中溶解氧浓度的增加有关,间接促进了${\rm{NH}}_4^ + $ -N的降解。5#电池的${\rm{NH}}_4^ + $ -N在运行的中后期以0.26 mg·(L·h)−1的速率降解,说明系统的脱氮功能受到严重的抑制作用。5组MFCs的pH始终保持稳定,是因为该实验单室MFCs系统通过同步硝化反硝化过程脱氮,硝化产生的酸度可以中和部分反硝化过程产生的碱度[18]。综上所述,单室MFCs体系中耗氧有机物(以COD计)可能参与以下4种反应:被阳极生物膜中的产电菌所利用;被渗入反应器中的氧气直接消耗;作为反硝化过程中的碳源被利用;被其他异养菌利用,即单室MFCs体系中耗氧有机物(以COD计)的去除是多种反应相互作用、相互反馈的结果,变量间的变化规律不呈单向,因此,DO与COD、C/N之间并未呈现明显的变化规律。验证上述推测还需要对电极生物膜进行高通量测序分析。
-
1)门水平下微生物群落结构分析。门水平下接种物及电池阴阳极生物膜的主要菌属如图7所示。其中好氧和厌氧接种物由IA和IC表示,5种碳氮比水平对应的阴阳极生物膜由C1/A1、C2/A2、C3/A3、C4/A4和C5/A5表示。可以看出,单室MFCs的阴极碳布上也附着了大量的微生物。厌氧接种物中的优势菌种为Proteobacteria(44.62%)、Bacteroidetes(36.45%)和Firmicutes(11.69%);好氧接种物种的优势菌种为Proteobacteria(51.30%)、Bacteroidetes(18.56%)和Patescibacteria(12.91%)。在1#~5#MFC中,阴极生物膜以Proteobacteria和Bacteroidetes为优势菌种,但丰度存在显著差异。其中Proteobacteria的丰度依次为75.66%(C1)、64.64%(C2)、46.25%(C3)、53.17%(C4)和44.24%(C5);Bacteroidetes的丰度分别为11.37%(C1)、23.14%(C2)、43.97%(C3)、41.42%(C4)和30.78%(C5)。C5中Planctomycetes以及Firmicutes的丰度增加,分别为3.53%和3.08%;而阳极生物膜以Proteobacteria、Bacteroidetes和Chloroflexi为优势菌种,Proteobacteria的丰度依次为38.78%(A1)、38.28%(A2)、48.28%(A3)、60.28%(A4)和47.19%(A5);Bacteroidetes的丰度分别为45.68%(A1)、19.38%(A2)、18.33%(A3)、16.20%(A4)和26.71%(A5);Chloroflexi的丰度分别为1.43%(A1)、14.14%(A2)、20.85%(A3)、8.76%(A4)和4.02%(A5)。有研究[19]表明,Proteobacteria和Bacteroidetes是高盐废水处理系统中的主要菌种;Firmicutes在一些极端环境中可以生存并且特定的属种能够进行异养硝化[20];而Actinobacteria可以进行反硝化,将
${\rm{NO}}_3^ - $ 和${\rm{NO}}_2^ - $ 还原为N2O气体释放[21],5组阴极生物膜中均检出了Actinobacteria,但丰度较低,依次为2.67%(C1)、1.04%(C2)、0.51%(C3)、0.52%(C4)和1.58%(C5);Chloroflexi门在有氧或无氧条件下均可以优先利用葡萄糖和N-乙酰氨基葡萄糖,但在pH较低的环境下利用率降低[22]。在门水平下,接种泥中的优势菌种在反应器中得以延续。2)属水平下微生物群落结构分析。属水平下接种物及电池阴阳极生物膜的主要菌属如图8所示。由图8(a)和图8(b)可以看出,在属水平下,厌氧接种泥的主要菌属为Thauera(37.63%)、norank_f_ML635J-40_aquatic_group(22.30%)和Lentimicrobium(5.24%);好氧接种泥的主要菌属为Thauera(26.87%)、Luteibacter(20.35%)、norank_o_Saccharimonadales(12.89%)和unclassified_o__Chitinophagales(10.60%),接种泥以Thauera为主。有研究[10-12]表明,Thauera能够在厌氧MFC中实现产电和有机物去除,并在同步硝化反硝化系统中通过异养硝化-好氧反硝化途径脱氮。
5组单室MFCs的阴极、阳极生物膜的菌属在属水平下有显著差异,同时为适应高盐水质,与接种污泥相比较微生物群落更为丰富,但Thauera始终为优势菌种,其丰度分别为30.59%和25.79%(C1、A1)、32.75%和34.75%(C2、A2)、25.01%和33.89%(C3、A3)、27.67%和27.30%(C4、A4)以及17.32%和18.06%(C5、A5)。除Thauera外,不同碳氮比条件下的优势菌种各有不同。在属水平下,发现15种与脱氮相关的功能菌,包括Thauera、Stappia、Acinetobacter、Arcobacter、Paracoccus、Rheinheimera、Sedimenticola、Sulfurimonas、Thioalbus、unclassified_f_Rhodocyclaceae、unclassified_f_Rhodobacteraceae、Soehngenia、Caldithrix、unclassified_f_Flavobacteriaceae和Flavobacterium。其中,Stappia[23]、Arcobacter[23]、Sedimenticola[24]、Thioalbus[25]、Soehngenia[26]、Sulfurimonas[27]为硫型自养反硝化菌,能够将底物中的硫化物氧化为高价硫,同时为硝酸盐的还原提供电子,以实现反硝化过程。有研究表明,Arcobacter[23]氧化硫化物的电子也可以提供给二氧化碳,用于合成有机物。Thauera、unclassified_f_Rhodocyclaceae[28-29]、Rheinheimera[30]、Acinetobacter[31]、Paracoccus[32-33]、unclassified_f_Rhodobacteraceae[34]、Flavobacterium[35]经证实具有异养硝化-好氧反硝化脱氮的功能,其中,Rheinheimera可以利用不同的碳源实现好氧反硝化[30];Acinetobacter能够在酸性条件下通过异养硝化-好氧反硝化过程实现了氮的去除[31]。而Caldithrix可利用分子氢或乙酸盐作为电子供体还原硝酸盐,也可以利用厌氧氨氧化过程产生的硝酸盐以实现更高的氮去除率[36]。unclassified_f_Flavobacteriaceae在溶解氧较低的条件下可以有机物为电子供体、硝酸盐或亚硝酸盐作为电子受体进行无氧呼吸代谢,若有机物充足,硝酸盐或亚硝酸盐可被还原为氮气[37]。在阴极生物膜中,具有异养硝化功能的微生物丰度依次为35.72%(C1)、46.90%(C2)、40.17%(C3)、35.63%(C4)和21.38%(C5),反硝化菌的丰度依次为47.17%(C1)、62.41%(C2)、51.28%(C3)、56.09%(C4)和21.38%(C5),其中,好氧反硝化菌的丰度分别为35.72%(C1)、52.60%(C2)、49.59%(C3)、45.08%(C4)和21.38%(C5)。值得注意的是,好氧接种物中自养硝化菌的丰度为3.07%,而该5组单室MFCs中自养硝化菌的丰度均低于<1%,说明硝化菌在与异养菌的竞争中处于劣势而逐渐被淘汰。推测异养硝化可能是该系统中氨氮转换的主要途径,同时,参与反硝化过程的菌属中,好氧反硝化菌所占比例较高,说明该单室MFCs主要通过好氧反硝化途径实现氮的去除。但由图6可见,各单室MFCs体系在周期运行的过程中,氨氮逐渐下降,同时未出现
${\rm{NO}}_3^ - $ -N和${\rm{NO}}_2^ - $ -N的积累,即硝化和反硝化作用是同时进行的,而DO的浓度仅在周期反应的后期有小幅增加,这主要是因为氧气能够通过碳能碳布和阴极生物膜进入电极液中,但在周期反应的前期,实验监测到电极液中的DO为零,即氧气在透过阴极生物膜的时候已被完全消耗,并达成动态平衡。因此,氧气跨膜的过程,为好氧反硝化菌对硝酸盐的利用提供了良好的条件,从而实现了好氧反硝化脱氮。在属水平下,还发现7种硫酸盐还原菌,分别为Desulfotignum[38]、Desulfomicrobium[24]、Dethiosulfatibacter[39]、Desulfococcus[40]、Desulfuromonas[41]、Desulfofustis[42]和Sulfurovum[43]。KAMARISIMA等[38]研究发现,当硝酸盐浓度(1 mmol·L−1)低于硫酸盐浓度(5 mmol·L−1)时,Desulfotignum可以将硫酸盐还原成硫化物;Dethiosulfatibacter通常以硫代硫酸盐作为电子受体将其还原为低价态硫[39];Desulfuromonas能够以Fe3+作为电子受体氧化乙醇、丙醇和丁醇[41];在厌氧环境下,Desulfofustis能够利用有机物将硫酸盐还原为H2S[42];Sulfurovum可以氢为电子供体实现硫酸盐的还原,并在硫酸盐浓度较高的环境中富集[43]。在阳极生物膜中,硫酸盐还原菌的丰度为1.0%(A1)、1.0%(A2)、4.33%(A3)、20.77%(A4)和27.15%(A5),SRB的丰度随着电极液中碳氮比的升高逐渐增大,并且SRB菌种也越来越丰富,即在硫酸盐浓度极低的条件下,SRB也可以在该单室MFCs中富集,同时,可以对系统的脱氮效率产生影响。值得注意的是,在C5生物膜中也检测出了硫酸盐还原菌Desulfotignum和Desulfomicrobium,丰度高达10.78%和2.39%,说明当电极液碳氮比为7∶1时,单室MFC呈现完全厌氧的状态。
2.1. 碳氮比对单室MFC产电性能的影响
2.2. 碳氮比对单室MFC中库仑效率及污染物去除效果的影响
2.3. 单室MFCs污染物去除过程分析
2.4. 单室MFCs微生物群落结构分析
-
1)单室MFCs在以不同碳氮比的高盐模拟废水(盐度为15 g·L−1)为阳极液时,可实现污染物去除和同步产电。
2)当碳氮比由3∶1依次增加至7∶1时,单室MFCs的产电性能逐渐优化,当碳氮比为7∶1时,功率密度最大,为7.33 W·m−3。
3)碳氮比不同的单室MFCs的污染物去除率存在差异。当C/N=4∶1时,耗氧有机物(以COD计)、
${\rm{NH}}_4^ + $ -N和TN的去除效果最佳,去除率分别为(86.17±2.4)%、(96.98±1.8)%和(96.64±1.8)%。4)碳氮比不同的单室MFCs对污染物的去除过程存在差异。在稳定产电周期内,COD及
${\rm{NH}}_4^ + $ -N在不同阶段表现出不同的去除速率,这主要与底物浓度有关。5)当接种物以Thauera为主时,单室MFCs可通过异养硝化-好氧反硝化途径实现氮的去除。









 DownLoad:
DownLoad:
